- Wolframio
-
Tantalio ← Wolframio → Renio Mo 
74W ↑
W
↓Sg Tabla completa • Tabla extendida Apariencia Blanco grisáceo, brilloso 
Información general Nombre, símbolo, número Wolframio, W, 74 Serie química Metal de transición Grupo, período, bloque 6, 6, d Masa atómica 183,84 u Configuración electrónica [Xe] 4f14 5d4 6s2[1] Dureza Mohs 7,5 Electrones por nivel 2, 8, 18, 32, 12, 2 Propiedades atómicas Radio medio 135 pm Electronegatividad 2,36 (Pauling) Radio atómico (calc) 193 pm (Radio de Bohr) Radio covalente 146 pm Estado(s) de oxidación 6, 5, 4, 3, 2 (levemente ácido) 1.ª Energía de ionización 770 kJ/mol 2.ª Energía de ionización 1700 kJ/mol 3.ª Energía de ionización kJ/mol Propiedades físicas Estado ordinario sólido Densidad 19250 kg/m3 Punto de fusión 3695 K Punto de ebullición 5828 K Entalpía de vaporización 82456 kJ/mol Entalpía de fusión 35,4 kJ/mol Presión de vapor 4,27 Pa a 3680 K Estructura cristalina Cúbica centrada en el cuerpo Calor específico 130 J/(K·kg) Conductividad térmica 174 W/(K·m) Módulo elástico 411 GPa Velocidad del sonido 5174 m/s a 293.15 K (20 °C) Isótopos más estables iso AN Periodo MD Ed PD MeV 180W 0,12% 1.8×1018 a α 2,516 176Hf 181W Sintético 121,2 d ε 0,188 181Ta 182W 26,50% Estable con 108 neutrones 183W 14,31% Estable con 109 neutrones 184W 30,64% Estable con 110 neutrones 185W 75,1 d β- 0,433 186W 28,43% Estable con 112 neutrones Nota: unidades según el SI y en CNPT, salvo indicación contraria. El wolframio o volframio, también llamado tungsteno, es un elemento químico de número atómico 74 que se encuentra en el grupo 6 de la tabla periódica de los elementos. Su símbolo es W.
Es un metal escaso en la corteza terrestre, se encuentra en forma de óxido y de sales en ciertos minerales. Es de color gris acerado, muy duro y denso, tiene el punto de fusión más elevado de todos los metales y el punto de ebullición más alto de todos los elementos conocidos.[2] Se usa en los filamentos de las lámparas incandescentes, en electrodos no consumibles de soldaduras, en resistencias eléctricas, y aleado con el acero, en la fabricación de aceros especiales.
Su variedad de carburo de wolframio sinterizado se emplea para fabricar herramientas de corte. Esta variedad absorbe más del 60% de la demanda mundial de wolframio.
El wolframio es un material estratégico y ha estado en la lista de productos más codiciados desde la Segunda Guerra Mundial. Por ejemplo, el gobierno de Estados Unidos mantiene unas reservas nacionales de seis meses junto a otros productos considerados de primera necesidad para su supervivencia.[3]
Este metal es fundamental para entender las sociedades modernas. Sin él no se podrían producir de una forma económica todas las máquinas que nos rodean y las cosas que se pueden producir con ellas.
Contenido
Historia
En 1779, Peter Woulfe, mientras estudiaba una muestra del mineral wolframita, (Mn, Fe) (WO4), predijo que debía de contener un nuevo elemento. Dos años después, en 1781, Carl Wilhelm Scheele y Torbern Bergman sugirieron que se podía encontrar un nuevo elemento reduciendo un ácido (denominado "ácido túngstico") obtenido a partir del mineral scheelita (CaWO4). En 1783, en España, los hermanos Juan José Elhúyar y Fausto Elhúyar encontraron un ácido, a partir de la wolframita, idéntico al ácido túngstico; el primero trajo el mineral consigo de su periplo por las minas y universidades europeas. En Uppsala (Suecia) tomó clases con Bergman el cual le habló de sus intuiciones respecto del wolframio. Así, consiguieron aislar el nuevo elemento mediante una reducción con carbón vegetal, en el Real Seminario de Vergara donde tenía su laboratorio la Real Sociedad Bascongada de Amigos del País. Más tarde, publicaron Análisis químico del wolfram y examen de un nuevo metal que entra en su composición describiendo este descubrimiento.[4] [5]
En 1820 el químico sueco Berzelius obtuvo wolframio mediante una reducción con hidrógeno. El método, empleado todavía actualmente, comenzó a abrir las posibilidades de uso de este metal extraordinario, pero su desarrollo fue muy lento. La necesidad constante de nuevos materiales para alimentar las guerras del siglo XIX hizo que los aceristas austriacos e ingleses empezaran a investigar las propiedades del wolframio como elemento de aleación. En la Universidad de Viena se experimentó con aleaciones a base de wolframio.[6]
Etimología
La palabra tungsteno procede del sueco; tung se traduce como "pesado" y sten, "piedra", es decir, "piedra pesada". El vocablo se debe al mineralogista sueco Axel Fredrik Cronstedt, descubridor del níquel, quien incluyó una descripción de este mineral desconocido en su libro "Ensayos de Mineralogía" de 1758. En la versión inglesa, bestseller académico de la época, se mantuvo la palabra tungsten, lo que explica su popularidad en el mundo anglosajón.
La palabra wolframio procede de las alemanas wolf y rahm, pudiendo significar "poco valor". También se traduce como "Baba de Lobo" en referencia a las supersticiones de los mineros medievales sajones que creían que el diablo se aparecía en forma de lobo y habitaba las profundidades de las minas corroyendo la casiterita con sus fauces babeantes. Este metal aparecía mezclado con el ácido de otro desconocido —wolframio— que actuaba corroyéndolo.[7]
Wolframio o tungsteno
La IUPAC denomina al elemento 74, de símbolo W, como tungsten (en inglés, su único idioma oficial). El nombre alternativo wolfram fue suprimido en la última edición de su Libro rojo (Nomenclatura de Química Inorgánica. Recomendaciones de la IUPAC de 2005) aunque dicha eliminación está en discusión, principalmente por miembros españoles de la IUPAC.[8]
El nombre de wolfram ya había sido adoptado oficialmente, en lugar de tungsten por la IUPAC en su 15ª conferencia, celebrada en Ámsterdam en 1949.[9]
Características
Propiedades físicas
En su forma natural, el wolframio es un metal gris acero que es a menudo frágil y difícil de trabajar, pero si es puro, se puede trabajar con facilidad.[3] Se trabaja por forjado, trefilado, extrusión y sinterización. De todos los metales en forma pura, el wolframio tiene el más alto punto de fusión (3.410 °C, 6.170 °F), menor presión de vapor (a temperaturas superiores a 1.650 °C, 3.002 °F) y la mayor resistencia a tracción.[10] Además, tiene el coeficiente de dilatación térmica más bajo de cualquier metal puro, y se detecta fácilmente con reactivo de Arnulphi en medio básico (KOH), tornándose este mismo incoloro. La expansión térmica es baja, su punto de fusión es alto y la fuerza se debe a fuertes enlaces covalentes que se forman entre los átomos de wolframio en el orbital 5d. Cabe señalarse que la aleación de pequeñas cantidades con el acero aumenta su resistencia.[11] [2]
Propiedades químicas
El wolframio resiste las reacciones redox, los ácidos y álcalis. El estado más común del wolframio es +6, pero presenta todos los estados de oxidación, desde -2 hasta +6.[12] [13] Normalmente se combina con el oxígeno para formar el óxido wolfrámico amarillo (WO3) que se disuelve en soluciones de alcalino acuoso para formar iones de wolframio (WO42-).
Los carburos de wolframio (W2C y WC) se producen por el calentamiento en polvo de carbón y son algunos de los carburos más duros, con un punto de fusión de 2.770 °C para WC y 2.780 °C para el W2C, el WC es un conductor eléctrico eficiente, pero el W2C no, el carburo se comporta de manera similar al mismo elemento sin alear, y es resistente al ataque químico, aunque reacciona fuertemente con el cloro para formar hexacloruro de wolframio (WCl6).[2]
Las soluciones acuosas se caracterizan por la formación de ácido heteropoliácido y aniones de polioxometalato en condiciones neutras y ácidas, además produce la acidificación del anión del metatungstato muy soluble, después de lo cual se alcanza el equilibrio.[14] Muchos aniones de polioxometalato existen en otras especies metaestables, la inclusión de un átomo de diferentes características, como el fósforo, en lugar de dos hidrógenos centrales, en el metatungstato produce una gran variedad de ácidos heteropoliácidos, como el ácido fosfotúngstico.
Usos
En estado puro se utiliza en la fabricación de filamentos para lámparas eléctricas, resistencias para hornos eléctricos con atmósfera reductoras o neutras, contactos eléctricos para los distribuidores de automóvil, ánodos para tubos de rayos X y de televisión.[10]
Tiene usos importantes en aleaciones para herramientas de corte a elevada velocidad (W2C), en la fabricación de bujías y en la preparación de barnices (WO3) y mordientes en tintorería, en las puntas de los bolígrafos y en la producción de aleaciones de acero duras y resistentes.
Los wolframatos de calcio y magnesio se utilizan en la fabricación de tubos fluorescentes.[15]
El carburo de wolframio, estable a temperaturas del orden de 500 °C, también se usa como lubricante seco.[2] [16]
 Accesorios para soldadura TIG.
Accesorios para soldadura TIG.
Para la soldadura TIG (Tungsten Inert Gas): consiste en usarlo de electrodo no fusible (que no se funde), para hacer de arco eléctrico entre la pieza y la máquina, ya que soporta 3.410 °C cuando es puro (se usa para soldar aluminio o magnesio, en corriente alterna). En este caso, el electrodo lleva un distintivo de color verde. Asimismo, si se alea con torio (al 2%), soporta los 4.000 °C y su uso alcanza la soldadura de aceros inoxidables, cobre y titanio, entre otros, en corriente continua, en cuyo caso la cinta pintada es de color rojo. También se dan aleaciones con otros elementos químicos, como el circonio, el lantano, etc.[17]
Desde la Segunda Guerra Mundial se usó para blindar la punta de los proyectiles anti-tanque, como en la munición AP, y en la coraza de los blindados.[3] [18]
También se usa para la fabricación de dardos, concretamente en los barriles de los dardos, en aleación con níquel, y en una proporción desde el 80% al 97%. En los últimos años se ha utilizado para la fabricación de joyas como brazaletes, anillos y relojes.[3] [19] [20]
Papel biológico
El wolframio es el elemento más pesado conocido por ser utilizado por cualquier ser vivo, no se ha utilizado por los eucariotas, pero es un nutriente esencial para algunas bacterias. Por ejemplo, las enzimas llamadas oxidorreductasas usan el wolframio de manera similar al molibdeno utilizando en un complejo de pterina con molibdopterina. La molibdopterina, a pesar de su nombre, no contiene molibdeno, pero puede ser un complejo con molibdeno o wolframio para su uso en los seres vivos, y utiliza enzimas para reducir los ácidos carboxílicos a aldehídos.[21] La primera enzima que requiere ser descubierta también requiere que el selenio, y en este caso, el wolframio de selenio funcione de forma análoga a la vinculación de las enzimas del molibdeno.[22] Una de las enzimas de la familia oxidorreductasa que emplean a veces de wolframio es conocido por usar una versión de molibdeno (selenio de molibdopterina).[23] Aunque una enzima que contiene xantina deshidrogenasa de las bacterias se ha encontrado para contener molibdopterina de wolframio y no a las proteínas de selenio, un complejo de molibdopterina de wolframio-selenio no ha sido definitivamente descrito.[24]
Efectos bioquímicos
En el suelo, se oxida convirtiéndose en un ion positivo. Es posible que se sustituya por molibdeno en algunas enzimas, y en tales casos, la enzima que resulta en los seres eucariotas, presumiblemente sería inerte. La química del suelo determina la forma de polimerización del wolframio; los suelos alcalinos causan volframatos monoméricos, mientras que los suelos ácidos ocasionan volframatos poliméricos.[25]
El tungstato de sodio y plomo han sido estudiados por sus efectos sobre las lombrices de tierra. El plomo es letal en sus niveles más bajos y el tungstato sódico es mucho menos tóxico, pero el tungstato inhibió por completo su capacidad reproductiva.[26] [27]
Abundancia y obtención
Para extraer el elemento de su mena, se funde ésta con carbonato de sodio obteniéndose wolframato de sodio, Na2WO4. El wolframato de sodio soluble se extrae después con agua caliente y se trata con ácido clorhídrico para conseguir ácido volfrámico, H2WO4. Este último compuesto, una vez lavado y secado, forma el óxido WO3, que se reduce con hidrógeno en un horno eléctrico. El fino polvo obtenido se recalienta en moldes en una atmósfera de hidrógeno, y se prensa en forma de barras que se enrollan y martillean a alta temperatura para hacerlas compactas y dúctiles.
Hay minerales de wolframio sobre todo en China, Bolivia, Portugal, Rusia, Corea del Sur, Perú y Estados Unidos (en California y Colorado). El 75% del wolframio procede de China (2002). En España se encuentran minerales de wolframio en León (Bierzo Occidental), Galicia, especialmente en Ponteceso (La Coruña), en Extremadura, especialmente en algunas localidades de Badajoz y en Tornavacas y Acebo (Cáceres), donde tuvo gran relevancia por la demanda generada durante la Segunda Guerra Mundial.
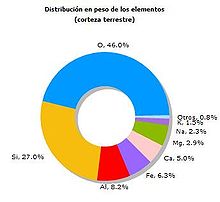
Este elemento ocupa el puesto 57º en la clasificación de elementos más abundantes de la corteza terrestre.
No se encuentra nunca libre en la naturaleza, sino en forma de sales combinado con otros elementos, principalmente como la scheelita (CaWO4) y la wolframita ((Fe,Mn)WO4), que son sus minerales más importantes. El wolframio natural es una mezcla de cinco isótopos estables. Además se conocen 21 isótopos inestables.
El wolframio se extrae de varios minerales wolfrámicos, como el volframita ((Fe,Mn)WO4),[28] la scheelita (CaWO4),[28] la cuproscheelita (CuWO4),[28] ferberita (FeWO4), la Hübnerita (MnWO4) y la stolzita (PbWO4).[28] Estos minerales se extraen y se utilizan para producir cerca de 37.400 toneladas de concentrados de tungsteno por año.[29] China produjo más del 75% de este total y la mayor parte de la producción restante procede de: Austria, Bolivia, Portugal y Rusia.[29]
El tungsteno se extrae de sus minas en varias etapas. El mineral se convierte posteriormente en trióxido de wolframio (WO3), que se calienta con hidrógeno o carbono para producir wolframio en polvo.[30] Se puede utilizar en ese estado o prensado en barras macizas.
El wolframio también puede ser extraído por reducción con hidrógeno de WF6:
- WF6 + 3 H2 → W + 6 HF
o por descomposición pirolítica:
- WF6 → W + 3 F2 (ΔHr = +)
Los precios del volframio se registran en la Bolsa de Metales de Londres. El precio de metal puro es de alrededor de $20.075 por tonelada.[31]
Compuestos
Puede presentar estados de oxidación desde -II a +IV, pero los más comunes son los elevados. La flexibilidad en el estado de oxidación da lugar a una serie de compuestos de valencia mixta. Sus compuestos más característicos son:
- Óxidos de volframio, y, a partir de ellos se consigue:
- Óxidos mixtos con metales alcalinos o alcalinotérreos
- Óxidos azules, de valencia mixta, que se preparan por reducción suave
- Bronces de volframio, de valencia mixta y no estequiométrico, con cierta proporción de sodio
- Volframatos simples
- Iso y heteropoliácidos y sus sales, polioxometalatos de una gran riqueza y variedad estructural
- Sulfuros y halogenuros
Isótopos
Naturalmente el wolframio consta de cinco isótopos cuyas vidas medias son tan largas que pueden considerarse estables. En teoría, los cinco isótopos pueden descomponerse en isótopos del hafnio por la emisión de radiaciones alfa, pero sólo el 180W se ha observado con una vida media de (1,8 ± 0,2)×1018 años,[32] en promedio, es el rendimiento alrededor de dos desintegraciones alfa de 180W en un gramo de volframio natural al año.[33] Los otros isótopos naturales que no se han observado directamente han limitando su vida media a:[33]
- 182W, T1/2 > 8,3×1018 años
- 183W, T1/2 > 29×1018 años
- 184W, T1/2 > 13×1018 años
- 186W, T1/2 > 27×1018 años
Otros 30 radioisótopos artificiales de wolframio se han caracterizado por tener una vida media estable, de los cuales181W tiene una vida media de 121,2 días, 185W con una vida media de 75,1 días, 188W con una vida media de 69,4 días, 178W con una vida media de 21,6 días, y 187W con una vida media de 23,72 h. Todos los demás isótopos tienen una vida media de menos de 3 horas, y la mayoría de éstos tienen una vida media inferior a 8 minutos.[33] El wolframio también tiene 4 isómeros nucleares, el más estable es 179mW (T½ 6.4 minutos).
Precauciones
Aunque los datos relativos a la toxicidad del wolframio son limitados, se tiene conocimiento de casos de intoxicación donde la dosis letal para los seres humanos se estima entre 500 mg/kg y 5 g/kg.[34] [35] Del wolframio se sabe que genera convulsiones e insuficiencia renal con necrosis tubular aguda.[36] [37] [38]
Los efectos del wolframio en el medio ambiente son prácticamente desconocidos, una preocupación que ha surgido es el uso cada vez más generalizado del material en plomadas para pescar, algunas de las cuales se pierden inevitablemente en el agua. La variable desconocida se aplica cuando el wolframio puede ser depositado en el medio ambiente, ya sea a sabiendas o sin darse cuenta.[39]
Véase también
Referencias
- ↑ «Why does Tungsten not 'Kick' up an electron from the s sublevel ?». Consultado el 15-06-2008.
- ↑ a b c d Daintith, John (2005). Facts on File Dictionary of Chemistry, 4th ed.. New York: Checkmark Books.
- ↑ a b c d Stwertka, Albert (2002). A Guide to the elements, 2nd ed.. New York: Oxford University Press.
- ↑ «ITIA Newsletter»(PDF), International Tungsten Industry Association, June 2005. Consultado el 18-06-2008.
- ↑ «ITIA Newsletter»(PDF), International Tungsten Industry Association, December 2005. Consultado el 18-06-2008.
- ↑ Stevens, Donald G. (1999). «World War II Economic Warfare: The United States, Britain, and Portuguese Wolfram». The Historian (Questia). http://www.questia.com/googleScholar.qst;jsessionid=LY1PyzmCc1D256Gvh5wpbhxKyTyvcm2FHpMwpcs2wW2XyytCh4pW!956463030?docId=5001286099.
- ↑ Peter van der Krogt. «Wolframium Wolfram Tungsten». Elementymology & Elements Multidict. Consultado el 11-03-2010.
- ↑ http://www.iupac.org/standing/ictns/ICTNS_09other-reports.pdf Report on the use of Wolfram as an Alternative Name for Tungsten, pag. 49-55 (en inglés)
- ↑ Wolframio, sí; tungsteno, no por Pascual Román Polo
- ↑ a b C. R. Hammond (2004). The Elements, in Handbook of Chemistry and Physics 81st edition. CRC press. ISBN 0849304857.
- ↑ Erik Lassner, Wolf-Dieter Schubert (1999). Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. Springer. p. 9. ISBN 0306450534. http://books.google.com/books?id=foLRISkt9gcC&pg=PA9.
- ↑ Emsley, John E. (1991). The elements, 2nd ed.. New York: Oxford University Press.
- ↑ «Ethylene Complexes of the Early Transition Metals: Crystal Structures of [HfEt4(C2H4)2−] and the Negative-Oxidation-State Species [TaHEt(C2H4)33−] and [WH(C2H4)43−]». Organometallics 27: pp. 984–993. 2008. doi:.
- ↑ Smith, Bradley J. (2000). «Quantitative Determination of Sodium Metatungstate Speciation by 183W N.M.R. Spectroscopy». Australian Journal of Chemistry (CSIRO) 53 (12). http://www.publish.csiro.au/paper/CH00140.htm.
- ↑ Turrell, Kerry (2004). Tungsten. Marshall Cavendish. p. 24. ISBN 0761415483. http://books.google.com/books?id=QUyO7jgvOQUC&pg=PA24.
- ↑ «The Canadian Encyclopaedia». Consultado el 05-05-2009.
- ↑ DeGarmo, E. Paul (1979). Materials and Processes in Manufacturing, 5th ed.. New York: MacMillan Publishing.
- ↑ Hesse, Rayner W. (2007). «tungsten». Jewelrymaking through history : an encyclopedia. Westport, Conn.: Greenwood Press. pp. 190–192. ISBN 9780313335075. http://books.google.com/books?id=DIWEi5Hg93gC&pg=PA190.
- ↑ Hesse, Rayner W. (2007). «tungsten». Jewelrymaking through history : an encyclopedia. Westport, Conn.: Greenwood Press. pp. 190–192. ISBN 9780313335075. http://books.google.com/books?id=DIWEi5Hg93gC&pg=PA190.
- ↑ Gray, Theo. «How to Make Convincing Fake-Gold Bars», Popular Science, 14 de marzo de 2008. Consultado el 18-06-2008.
- ↑ Lassner, Erik (1999). Tungsten: Properties, Chemistry, Technology of the Element, Alloys and Chemical Compounds. Springer. pp. 409–411. ISBN 0306450534. http://books.google.com/books?id=foLRISkt9gcC&pg=PA409&lpg=PA409&dq=tungsten+nutrient+organisms&source=web&ots=-rtHF9sWBY&sig=CoCD7Wp0HS-QRzQEoiPCisLaP04&hl=en&sa=X&oi=book_result&resnum=1&ct=result.
- ↑ Stiefel, E. I. (1998). «Transition metal sulfur chemistry and its relevance to molybdenum and tungsten enzymes». Pure & Appl. Chem. 70 (4): pp. 889–896. doi:. http://media.iupac.org/publications/pac/1998/pdf/7004x0889.pdf.
- ↑ Khangulov, S. V. et al. (1998). «Selenium-Containing Formate Dehydrogenase H from Escherichia coli: A Molybdopterin Enzyme That Catalyzes Formate Oxidation without Oxygen Transfer». Biochemistry 37: pp. 3518–3528. doi:.
- ↑ Schrader, Thomas; Rienhofer, Annette; Andreesen, Jan R. (1999). «Selenium-containing xanthine dehydrogenase from Eubacterium barkeri». Eur. J. Biochem. 264 (3): pp. 862–71. doi:.
- ↑ Chemical & Engineering News, 19 Jan. 2009, "Unease over Tungsten", p. 63
- ↑ Inouye, L. S. et al. (2006). «Tungsten effects on survival, growth, and reproduction in the earthworm, eisenia fetida». Environmental Toxicology & Chemistry 25 (3). doi:.
- ↑ McQuaid A; Lamand M; Mason J. (1994). «Thiotungstate-copper interactions II. The effects of tetrathiotungstate on systemic copper metabolism in normal and copper-treated rats». J Inorg Biochem 53. doi:.
- ↑ a b c d F. Burriel Martí, F. Lucena Conde, S. Arribas Jimeno, J. Hernández Méndez (2006). «Química analítica de los cationes: Volframio». Química analítica cualitativa (18ª edición edición). Thomson. pp. 450-457. ISBN 84-9732-140-5.
- ↑ a b Shedd, Kim B.. «Tungsten»(PDF), United States Geological Survey. Consultado el 18-06-2008.
- ↑ Saunders, Nigel (February de 2004). Tungsten and the Elements of Groups 3 to 7 (The Periodic Table). Chicago, Illinois: Heinemann Library. ISBN 1403435189.
- ↑ «Metal Bulletin». Consultado el 05-05-2009.
- ↑ C. Cozzini et al. (2004). «Detection of the natural α decay of tungsten». Phys. Rev. C 70. doi:. http://arxiv.org/abs/nucl-ex/0408006.
- ↑ a b c Alejandro Sonzogni. «Interactive Chart of Nuclides». Brookhaven National Laboratory. Consultado el 06-06-2008.
- ↑ Koutsospyros, A.; Braida, W.; Christodoulatos, C.; Dermatas, D.; Strigul, N. (2006). «A review of tungsten: From environmental obscurity to scrutiny». Journal of Hazardous Materials 136 (1): pp. 1–19. doi:. PMID 16343746.
- ↑ Masten, Scott (2003). «Tungsten and Selected Tungsten Compounds — Review of Toxicological Literature». National Institute of Environmental Health Sciences. Consultado el 19-03-2009.
- ↑ Marquet, P. et al. (1996). «A soldier who had seizures after drinking quarter of a litre of wine.». Lancet 348 (9034): pp. 1070. doi:. PMID 8874460.
- ↑ Lison, D. et al. (1997). «Toxicity of tungsten.». Lancet 349 (9044): pp. 58–9. PMID 8988138.
- ↑ Marquet, P. et al. (1997). «Tungsten determination in biological fluids, hair and nails by plasma emission spectrometry in a case of severe acute intoxication in man.». Journal of forensic sciences 42 (3): pp. 527–30. PMID 9144946.
- ↑ Strigul, N; Koutsospyros, A; Arienti, P; Christodoulatos, C; Dermatas, D; Braida, W (Oct 2005). «Effects of tungsten on environmental systems.». Chemosphere 61 (2): pp. 248–58. doi:. ISSN 0045-6535. PMID 16168748.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre WolframioCommons.
Wikimedia Commons alberga contenido multimedia sobre WolframioCommons. Wikcionario tiene definiciones para wolframio.Wikcionario
Wikcionario tiene definiciones para wolframio.Wikcionario- ATSDR en Español - ToxFAQs™: Tungsteno Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- ATSDR en Español - Resumen de Salud Pública: Tungsteno Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- Tungsten, The Periodic Table of Videos, The University of Nottingham (consultado 25 nov. 2010)
Categorías:- Aleaciones aeroespaciales
- Tungsteno
- Materiales superconductores
Wikimedia foundation. 2010.