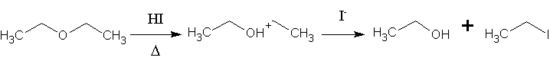- Yoduro de hidrógeno
-
Yoduro de hidrógeno


Nombre (IUPAC) sistemático Yoduro de hidrógeno General Otros nombres Ácido yodhídrico Fórmula semidesarrollada HI Fórmula molecular n/d Identificadores Número CAS 10034-85-2 Número RTECS MW3760000 Propiedades físicas Estado de agregación Gas Apariencia gas incoloro Densidad 2.850 kg/m3; 2.85 g/cm3 Masa molar 127,904 g/mol Punto de fusión 184,55 K (–50,8 °C) Punto de ebullición 237,79 K (–34,36 °C) Índice de refracción 1,466 Propiedades químicas Acidez (pKa) –10,0 Momento dipolar 0,38 D Termoquímica ΔfH0gas ? kJ/mol ΔfH0líquido ? kJ/mol ΔfH0sólido 0,2072 kJ/mol S0gas, 1 bar ? J·mol-1·K-1 S0líquido, 1 bar ? J·mol-1·K-1 S0sólido ? J·mol-1·K-1 Calor específico 0.2283 cal/g Peligrosidad NFPA 704 Frases R 20, 21, 22, 35 Frases S 7, 9, 26, 45 Número RTECS MW3760000 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl yoduro de hidrógeno (HI) es una molécula diatómica, este se encuentra como un gas incoloro bajo condiciones normales. A las soluciones acuosas producidas con yoduro de hidrógeno se les conoce como ácido yodhídrico, éste es un ácido fuerte. Ambos son interconvertibles. El HI es utilizado en la química orgánica e inorgánica como una de las principales fuentes de yodo y como agente reductor.
Contenido
Propiedades del yoduro de hidrógeno
El yoduro de hidrógeno es es un gas incoloro que reacciona con oxígeno para formar agua y yodo. En aire húmedo, este se halla como una niebla (o humo) de ácido yodhídrico. Es excepcionalmente soluble en agua, dando como resultado ácido yodhídrico. Un litro de agua disuelve 425 litros de HI, la solución definitiva tiene sólo cuatro moléculas de agua por molécula de HI.[1]
Propiedades del ácido yodhídrico
El ácido yodhídrico es una mezcla formada con HI. La solución forma un azeótropo de ebullición a 127 °C con 57% de HI y 43% de agua. Este ácido es uno de los más fuertes de todos los ácidos de haluro comunes, debido a la alta estabilidad de su base conjugada correspondiente. El ion de yoduro es mucho mayor que los otros haluros comunes, lo que resulta que la carga negativa se disperse en un espacio más grande. Por el contrario, un ion cloruro es mucho menor, por lo cual, su carga negativa está más concentrada, llevando a una mayor interacción entre los protones y los iones de cloruro. Esta débil interacción en el yoduro de hidrógeno facilita la disociación del protón desde el anión, y es la razón por la cual el HI es el ácido más fuerte de la .
Preparación
La preparación industrial de HI consiste en la reacción de I2 con hidrazina, que también produce gas nitrógeno.[2]
- 2I2 + N2H4 → 4HI + N2
Cuando se realiza en el agua, el HI debe ser destilada. El HI también puede ser destilado de una solución de yoduro de sodio o algún otro yoduro alcalino en ácido fosfórico concentrado (tenga en cuenta que el ácido sulfúrico no funcionará para yoduros acidificantes, ya que este oxida el yoduro a yodo elemental). Otra forma de prepararlo es por borboteo de vapor de ácido sulfúrico a través de una solución acuosa de yodo, lo cual forma ácido yodhídrico (este es destilado) y azufre (que es filtrado).
- H2S + I2 → 2HI + S
Además, el HI puede ser preparado por la simple combinación de H2 y I2. Este método es usualmente empleado para generar muestras de alta pureza.
- H2 + I2 → 2HI
Durante muchos años, esta reacción fue considerada como una reacción bimolecular simple entre moléculas de H2 y I2. Sin embargo, cuando una mezcla de los gases es irradiad con la longitud de onda de la luz igual a la energía de disociación de I2, alrededor de 578 nm, el ritmo aumenta de manera significativa. Esto apoya un mecanismo por el cual el I2 se disocia en 2 átomos de yodo, adhiriéndose cada uno de ellos se a un lado de la molécula de H2 y rompiendo el enlace entre los átomos de hidrógeno (H-H):[3]
- H2 + I2 + 578 nm de radiación → H2 + 2I → I — — — H — — — H — — — I → 2HI
En el laboratorio, otro método consiste en la hidrólisis del triyoduro de fósforo (PI3), el yodo equivalente de tribromuro de fósforo (PBr3). En este método, el I2 reacciona con el fósforo para crear triyoduro de fósforo, que reacciona con el agua formando HI y ácido fosforoso (H3PO3).
- 3I2 + 2P + 6H2O → 2PI3 + 6H2O → 6HI + 2H3PO 3
Reacciones y aplicaciones
El HI se someterá a la oxidación si entra en contacto con el oxígeno gaseoso del aire, de acuerdo a la siguiente fórmula:
- 4HI + O2 → 2H2O + 2I2
- HI + I2 → HI3
El HI3 es color café oscuro, pues hace años las soluciones de HI suelen aparecer café oscuro.
- HI + H2C=CH2 → H3CCH2I
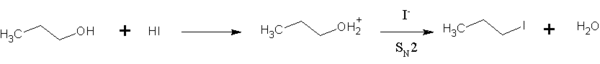
El HI es además utilizado para en la química orgánica para convertir alcoholes primarios en halogenoalcanos.[5] Esta reacción es una sustitución SN2, en la cual el ion de yoduro reemplaza el "activado" grupo hidroxilo (agua). El HI es preferido sobre sobre otros haluros de hidrógeno debido a que el ion de yoduro es un mejor nucloéfilo que el bromuro o el cloruro, por lo que la reacción puede llevarse a cabo a una velocidad razonable y sin exceso de calor. Esta reacción también tiene lugar el los alcoholes secundarios y terciarios, pero la sustitución ocurre a través de la via SN1.
El HI también puede ser usado para fraccionar éteres en los compuestos organoyodados y los alcoholes, en una reacción similar a la sustitución en los alcoholes. Este tipo de división es significativo ya que puede ser usado para convertir un éter químicamente estable e inerte en una especie más reactiva. En el siguiente ejemplo, el éter etílico es fraccionado en etanol y yoduro de etilo. La reacción es regio selectiva, como yoduro tiende a atacar el éter de carbón con menos dificultad estéricamente.[5]
El HI está sujeto a la misma regla de Markownikoff y las directrices anti-Markownikoff, así como en el HCl y el HBr.
El ácido yodhídrico puede ser usado para sintetizar el yoduro de sodio y el yoduro de potasio para incrementar el yoduro contenido en la sal.
Uso legal del ácido yodhídrico
El ácido yodhídrico figura dentro de la lista de drogas ilícitas de la Administración para la aplicación de drogas de los Estados Unidos debido a su utilidad como agente reductor. La reducción del HI y el fósforo rojo se ha convertido en el método más popular para la creación de metafetamina en los Estados Unidos. El HI reacciona con seudoefedrina para formar yodo-metafetamina, un intermediario el cual es reducido principalmente de la metafetamina[6]
Referencias
- ↑ Holleman, A.F.; Wiberg, E. Química Inorgánica Academic Press: San Diego (California), 2001. SBN 0-12-352651-5.
- ↑ Greenwood, N.N. y A. Earnshaw. La química delos elementos. 2do ed. Oxford: Butterworth-Heineman. pp. 809-815 (1997)
- ↑ Holleman, A.F. Wiberg, E. Química Inorgánica. San Diego (California): Academia Press. pp. 371, 432-433 (2001).
- ↑ Breton, G. W., P. J. Kropp, P. J.; Harvey, R. G. (2004). "Yoduro de hidrógeno". en L. Paquette. Enciclopedia de reactivos para síntesis orgánicas. Nueva York: Wiley & Sons
- ↑ a b Bruice, Paula Yurkanis. Química Orgánica 4ta ed. Prentice Hall: Upper Saddle River, N.J, pp. 438-439, 452 (2003).
- ↑ Skinner, Harry F. "Síntesis de la metafetamina via HI y la reducción de fósforo rojo de efedrina Ciencia Forense Internacional, 48 128-134 (1990).
Véase también
- Hidrácido
Categorías:- Hidrácidos
- Yoduros
Wikimedia foundation. 2010.