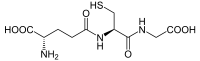
- Glutatión
-
El glutatión (GSH)[1] es un tripéptido no proteínico que deriva de aminoácidos. Contiene un enlace péptidico inusual entre el grupo amino de la cisteína y el grupo carboxilo de la cadena lateral del glutamato. El glutatión, un antioxidante, ayuda a proteger las células de especies reactivas de oxígeno como los radicales libres y los peróxidos.[2] El glutatión es nucleofílico en azufre y ataca los aceptores conjugados electrofílicos venenosos. Los grupos tiol se mantienen en un estado reducido a una concentración de aproximadamente ~ 5 mM en células animales. En efecto, el glutatión reduce cualquier enlace disulfuro formado dentro de proteínas citoplasmáticas de cisteínas, al actuar como un donante de electrones. En el proceso, el glutatión se convierte en su forma oxidada disulfuro de glutatión (GSSG). El glutatión se encuentra casi exclusivamente en su forma reducida, ya que la enzima que vuelve de su forma oxidada, la glutatión reductasa, es constitutivamente activa e inducible al estrés oxidativo. De hecho, la proporción de glutatión reducido a glutatión oxidado dentro de las células a menudo se utiliza científicamente como una medida de la toxicidad celular.[3]
H2O2 + 2GSH------- GSSG + 2 H2O.
Contenido
Biosíntesis
El glutatión no es un nutriente esencial, ya que puede ser sintetizado a partir de los aminoácidos L-cisteína, ácido L-glutámico y glicina. El sulfhidrilo (tiol), grupo (SH) de la cisteína, sirve como donador de protones y es responsable de la actividad biológica del glutatión. La prestación de este aminoácido es el factor limitante en la síntesis de glutatión en las células porque la cisteína es rara en los productos alimenticios. Por otra parte, si se libera, como el aminoácido libre, la cisteína es tóxica y de manera espontánea cataboliza en el tracto gastrointestinal y el plasma de la sangre.[4]
El glutatión se sintetiza en dos pasos dependientes del trifosfato de adenosina:
- En primer lugar, la gamma-glutamilcisteína se sintetiza a partir del L-glutamato y la cisteína a través de la enzima gamma-glutamilcisteína sintetasa (también conocida como glutamato cisteína ligasa, GCL). Esta reacción es el paso limitante en la síntesis de glutatión.
- En segundo lugar, la glicina se añade a la C-terminal de la gamma-glutamilcisteína a través de la enzima glutatión sintetasa.
En animales e insectos la glutamato cisteína ligasa (GCL) es una enzima heterodimérica compuesta por un catalizador (GCLC) y subunidad moduladora (GCLM). El GCLC constituye toda la actividad enzimática, mientras que la GCLM aumenta la eficiencia catalítica del GCLC. Los ratones que carecen de GCLC (es decir, todas las síntesis de nuevo GSH) mueren antes de nacer.[5] Los ratones que carecen de GCLM no demuestran fenotipo, pero exhiben una marcada disminución de GSH y una mayor sensibilidad a los tóxicos.[6] [7] [8]
Aunque todas las células del cuerpo humano son capaces de sintetizar el glutatión, la síntesis de glutatión del hígado se ha demostrado que es esencial. Después del nacimiento, los ratones con pérdida genética inducida de GCLC (es decir, la síntesis de GSH) sólo en el hígado mueren al cabo de 1 mes del nacimiento.[9]
La glutamato cisteína ligasa de las plantas (GCL) es una enzima redox homodimérica sensible, conservada en el reino vegetal.[10] En un ambiente oxidante se forman puentes disulfuro intermoleculares y la enzima cambia al estado dimérico activo. El potencial crítico medio de la parella de cisteína es - 318 mV.
Además del control redox está la enzima GCL inhibida por GSH.[11] La GCL está exclusivamente situada en los plastidios y la glutatión sintetasa esta en los plastidios y el citosol, por lo tanto son GSH y gamma-glutamylcisteína exportados de los plastidios.[12] Las dos biosíntesis de las enzimas del glutatión son esenciales en las plantas.[13]
La ruta de biosíntesis del glutatión se encuentra en algunas bacterias, como las cianobacterias y proteobacterias, pero está ausente en muchas otras bacterias. La mayoría de los eucariotas sintetizan glutatión, incluidos los humanos, pero algunos no, como las leguminosas, Entamoeba y Giardia.[14] [15]
Función
El glutatión existe en los estados reducido (GSH) y oxidado (GSSG). En el estado reducido, el grupo tiol de la cisteína es capaz de donar un equivalente de reducción (H+ + e-) a otras moléculas inestables, como las especies reactivas de oxígeno. En la donación de un electrón, el glutatión se convierte en reactivo, pero reacciona rápidamente con otro glutatión reactivo para formar disulfuro de glutatión (GSSG). Esta reacción es posible debido a la concentración relativamente alta de glutatión en las células (de hasta 5 mm en el hígado). El GSH puede regenerarse a partir de GSSG por la enzima glutatión reductasa.
En las células y tejidos sanos, más del 90% de glutatión total está en la forma reducida (GSH) y menos del 10% que existe en la forma disulfuro (GSSG). Un aumento de la proporción entre GSSG y GSH se considera un indicativo de estrés oxidativo.
Glutatión tiene múltiples funciones:
- 1. Es el mayor antioxidante endógeno producido por las células, participando directamente en la neutralización de radicales libres y compuestos de oxígeno reactivo, así como el mantenimiento de los antioxidantes exógenos, como las vitaminas C y E en sus formas reducidas (activas).
- 2. A través de la conjugación directa, desintoxica muchos xenobióticos (compuestos extraños) y los agentes carcinógenos, tanto orgánicos como inorgánicos.
- 3. Es esencial en el sistema inmunológico para ejercer todo su potencial, por ejemplo, la modulación de la presentación de antígenos a los linfocitos, lo que influye en la producción de citoquinas y el tipo de respuesta (celular o humoral) que se desarrolla, aumentar la proliferación de los linfocitos, lo que aumenta la magnitud de la respuesta, aumentar la actividad de eliminación de las células T citotóxicas y las células NK, y la regulación de la apoptosis, manteniendo así el control de la respuesta inmune.
- 4. Desempeña un papel fundamental en numerosas reacciones metabólicas y bioquímicas como la síntesis y reparación del ADN, la síntesis de proteínas, la síntesis de prostaglandinas, el transporte de aminoácidos y la activación de la enzima. Por lo tanto, todos los sistemas del cuerpo pueden ser afectados por el estado del sistema de glutatión, especialmente el sistema inmunitario, el sistema nervioso, el sistema gastrointestinal y los pulmones.
Función en los animales
El GSH es conocido como un sustrato en las dos reacciones de conjugación y las reacciones de reducción, catalizadas por la glutatión S-transferasa, enzima presente en el citosol, microsomas y las mitocondrias. Sin embargo, también es capaz de participar en la conjugación no-enzimática con algunos productos químicos, como en el caso de N-acetil-p-benzoquinona imina (NAPQI), el citocromo P450 reactivo, metabolito reactivo formado por paracetamol (o acetaminofeno, como es conocido en los EE.UU.), que se convierte en tóxico cuando el GSH se agota por una sobredosis de paracetamol.
El glutatión se conjuga a NAPQI y ayuda a desintoxicar, esta capacidad protege los grupos tiol celulares, que de lo contrario se modificarían en covalentementemente, cuando todo el GSH se ha gastado, la NAPQI comienza a reaccionar con las proteínas celulares, matando a las células en el proceso. El tratamiento que se prefiere para una sobredosis de este analgésico es la administración (por lo general en forma atomizada) de N-acetil-L-cisteína, que es procesado por las células a L-cisteína y utilizado en la síntesis de nuevo GSH.
El glutation (GSH) participa en la síntesis de los leucotrienos y es un cofactor de la enzima glutatión peroxidasa. También es importante como una molécula hidrofílica que se añade a las toxinas lipofílicas y residuos en el hígado durante la biotransformación antes de que puedan formar parte de la bilis. El glutatión es también necesario para la desintoxicación del metilglioxal, una toxina producida como un subproducto del metabolismo.
Esta reacción de desintoxicación se lleva a cabo por el sistema de glioxalasa. La glioxalasa I cataliza la conversión de glutatión metilglioxal y glutatión reducido a SD-lactoil-glutatión. La glioxalasa II cataliza la hidrólisis de la SD-lactoil-glutatión a glutatión y ácido D-láctico.
El glutatión se ha utilizado recientemente como un inhibidor de melanina en la industria cosmética. En países como Filipinas, este producto se vende como un jabón blanqueador. El glutatión inhibe competitivamente la síntesis de melanina en la reacción de la tirosinasa y la L-dopa mediante la interrupción de la capacidad de la L-DOPA para unirse a la tirosinasa durante la síntesis de melanina. La inhibición de la síntesis de melanina se ve contrarrestada por el aumento de la concentración de L-DOPA, pero no por el aumento de la tirosinasa. Aunque la melanina sintetizada fue agregada en 1 h, la suma fue inhibida por la adición de glutatión. Estos resultados indican que inhibe la síntesis de glutatión y la aglutinación de melanina por la interrupción de la función de L-DOPA."[16]
Función de las plantas
En las plantas de glutatión es crucial para el manejo del estrés biótico y abiótico. Es un componente fundamental del ciclo glutatión-ascorbato, un sistema que reduce el peróxido de hidrógeno[17] tóxico. Es el precursor de las phitochelatinas, oligomeres del glutatión que quelan los metales pesados como el cadmio.[18] El glutatión es necesario para la defensa contra los patógenos de las plantas, tales como Pseudomonas syringae y brassicae Phytophthora.[19] La APS reductasa, una enzima de la vía de asimilación de azufre, utiliza glutatión como donante de electrones. Otras enzimas que utilizan glutatión como sustrato son la glutaredoxina, estas pequeñas oxidorreductasas están implicadas en el desarrollo de flores, el ácido salicílico y la deñalizacion de defensa de la planta.[20]
La suplementación
La suplementación ha sido difícil, ya que la investigación sugiere que el glutatión por vía oral no se absorbe bien a través del tracto gastrointestinal. En un estudio de la administración oral aguda de una dosis muy grande (3 gramos) de glutatión, Witschi y compañeros de trabajo encontraron que "no es posible aumentar la circulación de glutatión en un grado clínicamente beneficioso con la administración oral de una dosis única de 3 g de glutatión."[21] [22]
Sin embargo, las concentraciones plasmáticas y del hígado de glutatión pueden ser levantadas por la administración oral de S-adenosil-metionina (SAM)[23] [24] [25] Los precursores de glutatión ricos en cisteína incluyen N-acetilcisteína (NAC)[26] [27] y proteína del suero sin desnaturalizar,[28] [29] [30] [31] [32] [33] [34] [35] y estos suplementos se ha demostrado que aumentan el contenido de glutatión de la célula. La N-acetilcisteína está disponible como un medicamento y como un suplemento genérico. El ácido alfa lipoico también se ha demostrado que restaura el glutatión intracelular.[36] [37] La melatonina se ha demostrado que estimula una enzima relacionada, la glutatión peroxidasa,[38] y la silimarina o cardo de leche también se ha demostrado que tiene capacidad para reponer los niveles de glutatión. De todos estos métodos, los dos métodos que son más investigados para la eficacia en el aumento del glutatión intracelular son variantes de la cisteína. La N acetil cisteína, que es un fármaco sobre la lucha contra las drogas, y la cisteína consolidada como se encuentra en los nutracéticos immunocales de la proteína del suero sin desnaturalizar, se ha demostrado que son eficaces en el aumento de los valores de glutatión.[39] [40]
El glutatión es un componente intracelular fuertemente regulado y limitado en su producción debido a la inhibición de retroalimentación negativa de su propia síntesis a través de la enzima gamma-sintetasa glutamilcisteína, así en gran medida se reduce al mínimo cualquier posibilidad de sobredosis. El aumento de glutatión es una estrategia para hacer frente a los estados de deficiencia de glutatión, el alto estrés oxidativo, la deficiencia inmune, y la sobrecarga de xenobióticos en el que el glutatión desempeña un papel en la detoxificación de los xenobióticos en cuestión. Los estados de deficiencia de glutatión incluyen, pero no están limitados a: VIH / sida, la química y la hepatitis infecciosa, cáncer de próstata y otros tipos de cáncer, cataratas, Alzheimer, Parkinson, enfermedad pulmonar obstructiva crónica, asma, envenenamiento por radiación, estados de malnutrición, estrés físico arduo, envejecimiento, y se ha asociado con sub-respuesta inmune óptima. Muchas patologías clínicas están asociadas con el estrés oxidativo y se detallan en numerosas referencias médicas.[4]
El nivel de glutatión bajo también está fuertemente implicado en el desgaste y el balance[41] negativo de nitrógeno, en particular, se ve en el cáncer, el sida, la sepsis, los traumatismos, las quemaduras e incluso el sobreentrenamiento deportivo. El suplemento de glutatión puede oponerse a este proceso y en el sida, por ejemplo, dan como resultado mejores tasas de supervivencia.[42]
Cáncer
El glutatión ha mostrado resultados positivos en varios estudios preliminares de la capacidad del glutatión a afectar los niveles de especies reactivas de oxígeno, que podría tener repercusiones en la reducción de los tipos de cáncer[43] .[44]
Sin embargo, al conferir resistencia a varios fármacos quimioterapéuticos, los elevados niveles de glutatión en las células tumorales son capaces de proteger a estas células en la médula ósea, mama, colon, laringe y pulmón.[45]
Patología
El exceso de glutamato en las sinapsis, que puede ser liberada en condiciones tales como en una lesión cerebral traumática, puede impedir la absorción de cisteína, un componente necesario del glutatión. Sin la protección de la lesión oxidativa otorgada por el glutatión, las células pueden ser dañadas o destruidas.[46]
Métodos para determinar el glutatión
El glutatión reducido se puede rociar con reactivo de Ellman o derivados de bímano, como el monobromobimán. El método monobromobimán es más sensible, en este procedimiento se alisan las células y tioles extraídos mediante un buffer de HCl. Posteriormente los tioles son reducidos con TDT y etiquetados con monobromobimán. El monobrombimán se vuelve fluorescente tras su unión al GSH. Los tioles se separan por HPLC y la fluorescencia puede cuantificarse con un detector de fluorescencia. El bímano también puede ser utilizado para cuantificar el glutatión in vivo. La cuantificación se realiza por CLSM después de la aplicación del colorante a las células vivas.[47] El otro enfoque, que permite medir el potencial redox del glutatión con una resolución espacial y temporal en las células vivas, se basa en las imágenes redox utilizando la proteína verde fluorescente sensible al redox (roGFP).[48]
Véase también
- Péptido
- Deficiencia de glutatión sintetasa
- El ácido Oftálmico
- roGFP, una herramienta para medir el potencial redox del glutatión celular.
- Ciclo ascorbato del glutatión.
Enlaces externos
- La Importancia del Glutatión en el cuerpo humano.
- Glutatión, artículo en Coenzima.com
Referencias
- ↑ Merck Index, 11th Edition, 4369.
- ↑ Pompella A, Visvikis A, Paolicchi A, De Tata V, Casini AF (October 2003). «The changing faces of glutathione, a cellular protagonist». Biochem Pharmacol. 66 (8): pp. 1499–503. doi:. PMID 14555227. http://linkinghub.elsevier.com/retrieve/pii/S0006295203005045.
- ↑ Pastore A, Piemonte F, Locatelli M, Lo Russo A, Gaeta LM, Tozzi G, Federici G (October 2003). «Determination of blood total, reduced, and oxidized glutathione in pediatric subjects». Clin. Chem. 47 (8): pp. 1467–1469. PMID 11468240. http://www.clinchem.org/cgi/content/extract/47/8/1467.
- ↑ a b «Immunocal Powder Sachets patient advice including side effects».
- ↑ Dalton, TPTP; et al., MZ; Yang, Y; Shertzer, HG; Nebert, DW (2000). «Knockout of the Mouse Glutamate Cysteine Ligase Catalytic Subunit (Gclc) Gene: Embryonic Lethal When Homozygous, and Proposed Model for Moderate Glutathione Deficiency When Heterozygous». Biochem Biophys Res Commun. 279 (2): pp. 324. doi:. PMID 11118286.
- ↑ Yang Y; Dieter, MZ; Chen, Y; Shertzer, HG; Nebert, DW; Dalton, TP (2002). «Initial Characterization of the Glutamate-Cysteine Ligase Modifier Subunit Gclm(-/-) Knockout Mouse. NOVEL MODEL SYSTEM FOR A SEVERELY COMPROMISED OXIDATIVE STRESS RESPONSE». J Biol Chem 277 (51): pp. 49446. doi:. PMID 12384496.
- ↑ Giordano G, G; Afsharinejad, Z; Guizzetti, M; Vitalone, A; Kavanagh, TJ; Costa, LG (2007). «Organophosphorus insecticides chlorpyrifos and diazinon and oxidative stress in neuronal cells in a genetic model of glutathione deficiency». Toxicol Appl Pharmacol 219 (2-3): pp. 181. doi:. PMID 17084875.
- ↑ McConnachie LA, Mohar I, Hudson FN (October 2007). «Glutamate cysteine ligase modifier subunit deficiency and gender as determinants of acetaminophen-induced hepatotoxicity in mice». Toxicol Sci. 99 (2): pp. 628–36. doi:. PMID 17584759.
- ↑ Chen Y, Y; Yang, Y; Miller, ML; Shen, D; Shertzer, HG; Stringer, KF; Wang, B; Schneider, SN et ál. (2007). «Hepatocyte-specificGclc deletion leads to rapid onset of steatosis with mitochondrial injury and liver failure». Hepatology 45 (5): pp. 1118. doi:. PMID 17464988.
- ↑ Hothorn M, Wachter A, Gromes R, Stuwe T, Rausch T, Scheffzek K (September 2006). «Structural basis for the redox control of plant glutamate cysteine ligase.». J Biol Chem 15 (37): pp. 27557–65. doi:. PMID 16766527.
- ↑ Hicks LM, Cahoon RE, Bonner ER, Rivard RS, Sheffield J, Jez JM (August 2007). «Thiol-based regulation of redox-active glutamate-cysteine ligase from Arabidopsis thaliana.». Plant Cell 19 (8): pp. 2653–61. doi:. PMID 17766407.
- ↑ Wachter A, Wolf S, Steininger H, Bogs J, Rausch T. (January 2005). «Differential targeting of GSH1 and GSH2 is achieved by multiple transcription initiation: implications for the compartmentation of glutathione biosynthesis in the Brassicaceae.». Plant J 41 (1): pp. 15–30. doi:. PMID 15610346.
- ↑ Pasternak M, Lim B, Wirtz M, Hell R, Cobbett CS, Meyer AJ (March 2008). «Restricting glutathione biosynthesis to the cytosol is sufficient for normal plant development.». Plant J 53 (6): pp. 999–1012. doi:. PMID 18088327.
- ↑ Shelley D. Copley and Jasvinder K. Dhillon (2002). «Lateral gene transfer and parallel evolution in the history of glutathione biosynthesis genes» (free full text). Genome biology 3: research0025.1. doi:. http://genomebiology.com/2002/3/5/RESEARCH/0025.
- ↑ Grill D, Tausz T, De Kok LJ (2001). Significance of glutathione in plant adaptation to the environment. Springer. ISBN 1402001789. http://books.google.com/books?hl=sv&lr=&id=aX2eJf1i67IC&oi=fnd&pg=PA13&ots=8feo-QOEPa&sig=XAMjZ0Wan17vmoUKg_FFNRl8g0I#PPP1,M1.
- ↑ «[Inhibitory mechanism of melanin synthesis by glut... [Yakugaku Zasshi. 2008] - PubMed result».
- ↑ Noctor G, Foyer CH (June 1998). «ASCORBATE AND GLUTATHIONE: Keeping Active Oxygen Under Control». Annu Rev Plant Physiol Plant Mol Biol 49: pp. 249–279. doi:. PMID 15012235.
- ↑ Suk-Bong Ha, Aaron P. Smith, Ross Howden, Wendy M. Dietrich, Sarah Bugg, Matthew J. O'Connell, Peter B. Goldsbrough, and Christopher S. Cobbett (1999). «Phytochelatin Synthase Genes from Arabidopsis and the Yeast Schizosaccharomyces pombe». Plant Cell 11 (6): pp. 1153–1164. doi:. PMID 10368185. PMC 144235. http://www.plantcell.org/cgi/content/full/11/6/1153.
- ↑ Parisy V, Poinssot B, Owsianowski L, Buchala A, Glazebrook J, Mauch F (January 2007). «Identification of PAD2 as a gamma-glutamylcysteine synthetase highlights the importance of glutathione in disease resistance of Arabidopsis.». Plant J. 49 (1): pp. 159–72. doi:. PMID 17144898.
- ↑ Rouhier N, Lemaire SD, Jacquot JP (2008). «The role of glutathione in photosynthetic organisms: emerging functions for glutaredoxins and glutathionylation». Annu Rev Plant Biol 59: pp. 143–66. doi:. PMID 18444899.
- ↑ Witschi A, Reddy S, Stofer B, Lauterburg BH (1992). «The systemic availability of oral glutathione». Eur J Clin Pharmacol. 43 (6): pp. 667–9. doi:. PMID 1362956.
- ↑ AIDS Line Update
- ↑ Liber CS (November 2002). «S-Adenosyl-L-methionine: its role in the treatment of liver disorders». Am J Clin Nutr. 76 (5): pp. 1183S–1187S. PMID 12418503.
- ↑ Vendemiale G, Altomare E, Trizio T, Le Grazie C, Di Padova C, Salerno MT, Carrieri V, Albano O. (May 1989). «Effects of oral S-adenosyl-L-methionine on hepatic glutathione in patients with liver disease». Scand J Gastroenterol. 24 (9): pp. 407–15. doi:. PMID 2781235.
- ↑ Loguercio C, Nardi G, Argenzio F, Aurilio C, Petrone E, Grella A, Del Vecchio Blanco C, Coltorti M. (September 1994). «Effect of S-adenosyl-L-methionine administration on red blood cell cysteine and glutathione levels in alcoholic patients with and without liver disease». Alcohol Alcohol. 29 (5): pp. 597–604. PMID 7811344.
- ↑ Acetylcysteine and glutathione, PubMed
- ↑ Gross CL, Innace JK, Hovatter RC, Meier HL, Smith WJ (1993). «Biochemical manipulation of intracellular glutathione levels influences cytotoxicity to isolated human lymphocytes by sulfur mustard». Cell Biol. Toxicol. 9 (3): pp. 259–67. doi:. PMID 8299004.
- ↑ Glutathione information for Physicians
- ↑ Micke P, Beeh KM, Schlaak JF, Buhl R (February 2001). «Oral supplementation with whey proteins increases plasma glutathione levels of HIV-infected patients». Eur. J. Clin. Invest. 31 (2): pp. 171–8. doi:. PMID 11168457.
- ↑ Moreno YF, Sgarbieri VC, da Silva MN, Toro AA, Vilela MM (February 2006). «Features of whey protein concentrate supplementation in children with rapidly progressive HIV infection». J. Trop. Pediatr. 52 (1): pp. 34–8. doi:. PMID 16014759.
- ↑ Grey V, Mohammed SR, Smountas AA, Bahlool R, Lands LC (December 2003). «Improved glutathione status in young adult patients with cystic fibrosis supplemented with whey protein». J. Cyst. Fibros. 2 (4): pp. 195–8. doi:. PMID 15463873.
- ↑ Micke P, Beeh KM, Buhl R (February 2002). «Effects of long-term supplementation with whey proteins on plasma glutathione levels of HIV-infected patients». Eur J Nutr 41 (1): pp. 12–8. doi:. PMID 11990003.
- ↑ Bounous G, Baruchel S, Falutz J, Gold P (June 1993). «Whey proteins as a food supplement in HIV-seropositive individuals». Clin Invest Med 16 (3): pp. 204–9. PMID 8365048.
- ↑ Bounous G, Gold P (August 1991). «The biological activity of undenatured dietary whey proteins: role of glutathione». Clin Invest Med 14 (4): pp. 296–309. PMID 1782728.
- ↑ Bounous et al. Multiple references on glutathione enhancement with bioactive whey protein in multiple disease states
- ↑ Shay KP, Moreau RF, Smith EJ, Smith AR, Hagen TM (2009). «Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential». Biochim Biophys Acta. 1790 (Aug 4): pp. 1149–60. doi:. PMID 19664690.
- ↑ Busse E, Zimmer G, Schopohl B, Kornhuber B. (1992). «Influence of alpha-lipoic acid on intracellular glutathione in vitro and in vivo». Arzneimittelforschung. 42 (6): pp. 829–31. PMID 1418040.
- ↑ Barlow-Walden LR, Reiter RJ, Abe M, Pablos M, Menendez-Pelaez A, Chen LD, Poeggeler B. (1995). «Melatonin stimulates brain glutathione peroxidase activity». Neurochem Int. 26 (5): pp. 497–502. doi:. PMID 7492947.
- ↑ Nencini C, Giorgi G, Micheli L (2007). «Protective effect of silymarin on oxidative stress in rat brain». Phytomedicine. 14 (2-3): pp. 129–35. doi:. PMID 16638633.
- ↑ Valenzuela A, Aspillaga M, Vial S, Guerra R (1989). «Selectivity of silymarin on the increase of the glutathione content in different tissues of the rat». Planta Med. 55 (5): pp. 420–2. doi:. PMID 2813578.
- ↑ Dröge W, Holm E. (1997). «Role of cysteine and glutathione in HIV infection and other diseases associated with muscle wasting and immunological dysfunction». FASEB J. 11 (13): pp. 1077–89. PMID 9367343.
- ↑ Herzenberg LA, De Rosa SC, Dubs JG, Roederer M, Anderson MT, Ela SW, Deresinski SC, Herzenberg LA (1997). «Glutathione deficiency is associated with impaired survival in HIV disease». Proc Natl Acad Sci USA. 94 (5): pp. 1967–72. doi:. PMID 9050888.
- ↑ Han YH, Park WH (Aug 2009). «The effects of N-acetyl cysteine, buthionine sulfoximine, diethyldithiocarbamate or 3-amino-1,2,4-triazole on antimycin A-treated Calu-6 lung cells in relation to cell growth, reactive oxygen species and glutathione». Oncol Rep 22 (2): pp. 385–91. PMID 19578781.
- ↑ Chow HH, Hakim IA (Aug 2007). «Modulation of human glutathione s-transferases by polyphenone intervention». Cancer Epidemiol Biomarkers Prev. 16 (8): pp. 1662–6. doi:. PMID 17684143.
- ↑ Balendiran GK, Dabur R, Fraser D. (Nov-Dec 2004). «The role of glutathione in cancer». Cell Biochem Funct 22 (6): pp. 343–52. doi:. PMID 15386533.
- ↑ Pereira C.F, de Oliveira C.R. (Jul 2000). «Oxidative glutamate toxicity involves mitochondrial dysfunction and perturbation of intracellular Ca2+ homeostasis». Neuroscience Research 37 (3): pp. 227–36. doi:. PMID 10940457.
- ↑ Meyer AJ, May MJ, Fricker M (2001). «Quantitative in vivo measurement of glutathione in Arabidopsis cells.». Plant J 27 (1): pp. 67–78. doi:. PMID 11489184.
- ↑ Meyer, A.J., Brach, T., Marty, L., Kreye, S., Rouhier, N., Jacquot, J.P., and Hell, R. (2007). «Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer.». Plant J 52 (5): pp. 973–86. doi:. PMID 17892447.
Investigación relacionada
- Drevet JR (May 2006). "The antioxidant glutathione peroxidase family and spermatozoa: a complex story". Mol Cell Endocrinol. 250 (1-2): 70–9. doi:10.1016/j.mce.2005.12.027. PMID 16427183.
- The Role of Glutathione in Cell Defense.
- Wu G, Fang YZ, Yang S, Lupton JR, Turner ND (1 March 2004). "Glutathione metabolism and its implications for health". J Nutr. 134 (3): 489–92. PMID 14988435. http://jn.nutrition.org/cgi/pmidlookup?view=long&pmid=14988435.
Categorías:- Péptidos
- Transducción de señales
Wikimedia foundation. 2010.