- Historia de la pila
-
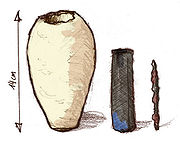
 Ilustraciones del propio Volta de su Corona de elementos y su pila voltaica, las primeras baterías de celdas electroquímicas conectadas en serie.[1]
Ilustraciones del propio Volta de su Corona de elementos y su pila voltaica, las primeras baterías de celdas electroquímicas conectadas en serie.[1]
La historia de la pila refleja el desarrollo histórico de las diferentes celdas electroquímicas empleadas para obtener una corriente eléctrica a partir de la energía química contenida en unas sustancias químicas que sufren una reacción de oxidación-reducción.
En este caso, el nombre de pila se refiere de modo genérico a todos los dispositivos que generan una corriente continua a partir de una reacción química, aunque existen diferencias entre ellos: celdas voltaicas (primarias y secundarias), pilas eléctricas, acumuladores, baterías y pilas de combustible. Para ver dichas diferencias, consultar el artículo sobre generadores electroquímicos.
La batería de Bagdad de la antigüedad
Vease también: Batería de bagdad
Alrededor de 1936, los arqueólogos descubrieron en una aldea cercana a Bagdad, un conjunto de vasijas de terracota cada una de las cuales contenía un rollo de lámina de cobre que albergaba una varilla de hierro. Algunos científicos especulan que estos artilugios podrían ser antiguas celdas galvánicas (alrededor de 2.000 años de antigüedad, aunque el cálculo de la edad sigue siendo debatido), a los que se les denomina la "Batería de Bagdad". Se cree que un ácido común de los alimentos, como el jugo de limón o vinagre, sirvió como un electrolito. Las réplicas modernas han producido con éxito corrientes eléctricas, dando crédito a esta hipótesis. Si la muestra fue de hecho una batería, pudo haber sido usada para galvanoplastia, para producir leves descargas eléctricas como fuente de experiencia religiosa, o simplemente utilizada para almacenar rollos antiguos.[2]
1800 - La pila voltaica
En 1780, Luigi Galvani estaba diseccionando una rana, sujeta con un gancho de metal. Cuando tocó la pata de la rana con su bisturí de hierro, la pierna se encogió como si el animal aún estuviese vivo. Galvani creía que la energía que había impulsado la contracción muscular observada venía de la misma pierna, y la llamó "electricidad animal".
Sin embargo, Alessandro Volta, un amigo y colega científico, no estaba de acuerdo, creyendo que este fenómeno estaba causado realmente por la unión o contacto entre dos metales diferentes que estaban unidos por una conexión húmeda. El propio Volta verificó experimentalmente esta hipótesis, y la publicó en 1791. Fue perfeccionada hasta que, en 1800, Volta inventó la primera batería o generador electroquímico capaz de producir una corriente eléctrica mantenida en el tiempo, y por ello fue conocida como pila voltaica. La pila voltaica consiste de pares de discos de cobre y zinc apilados uno encima del otro (de ahí el nombre de pila) , separados por una capa de tela o de cartón impregnado en salmuera (este era el electrolito). A diferencia de la botella de Leyden, la pila voltaica producía una corriente continua y estable, y perdía poca carga con el tiempo cuando no se la utiliza, aunque sus primeros modelos no podían producir una tensión lo suficientemente fuerte como para producir chispas.[3] Experimentó con diversos metales y encontró que el zinc y la plata le dio los mejores resultados.
Volta creía que la corriente se producía como resultado de la unión entre dos materiales diferentes, con sólo tocarse uno al otro (esta teoría científica obsoleta fue conocida como la tensión de contacto), y no como resultado de reacciones químicas (sin embargo, véase efecto termoeléctrico). En consecuencia, consideró que la corrosión que sufrían las planchas de zinc podía ser un defecto relacionado que tal vez podría corregirse de alguna manera con el cambio de materiales. Sin embargo, ningún científico había conseguido evitar esta corrosión. De hecho, se observó que la corrosión era más rápido cuando se producía más corriente. Esto sugirió que la corrosión era realmente parte integrante de la capacidad de la la batería para producir una corriente. Esto, en parte, llevó al rechazo de la teoría de la tensión de contacto en favor de la teoría electroquímica. En las ilustraciones de Volta de su pila de corona y la pila voltaica (primera figura de arriba), aparecen discos de metal extra, ahora sabemos que innecesarios, en la parte superior y en la inferior. La figura que aparece en esta sección, de la pila voltaica de zinc-cobre, tiene el diseño moderno, una indicación de que "la tensión de contacto" no es la fuente o causa de la fuerza electromotriz de la pila voltaica.
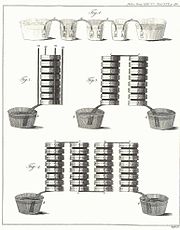
Los modelos de pila originales de Volta tienen algunos fallos técnicos, como fugas del electrólito y cortocircuitos provocados debido al peso de los discos que comprimen los paños empapados en la salmuera. El inglés William Cruickshank resolvió este problema mediante la fijación de los elementos en una caja en lugar de amontonarlos en una pila. Esto fue conocido como la batería de artesa.[4] El propio Volta diseñó una variante que consiste en una cadena de vasos llenos de una solución de sal, unidos por arcos metálicos sumergidos en el líquido. Esto fue conocido como la Corona de Copas o pila de corona. Estos arcos estaban hechos de dos metales diferentes (por ejemplo, zinc y cobre), soldados entre sí. Este modelo también demostró ser más eficiente que las pilas originales,[5] aunque no fue tan popular.
Otro problema de las pilas de Volta era su corta duración (una hora en el mejor de los casos), lo cual estaba causado por dos fenómenos. El primero era que la corriente producía la electrolisis de la disolución de electrólitos, lo que originaba una película de burbujas de hidrógeno que se formaban en el electrodo de cobre, que aumentaba constantemente la resistencia interna de la batería (Este efecto, llamado polarización, es contrarrestado en las células modernas con medidas adicionales). El otro era un fenómeno llamado de acción local, por el cual se formaban minúsculos cortocircuitos en torno a las impurezas del cinc, causando su degradación. Este último problema fue resuelto en 1835 por William Sturgeon, quien descubrió que mezclando algo de mercurio con el zinc se eliminaba este inconveniente.[6]
A pesar de sus defectos, las pilas de Volta proporcionaban una corriente más permanente que las jarras o botellas de Leyden, e hizo posible muchos experimentos y descubrimientos nuevos, como la electrolisis del agua, realizada por primera vez por Anthony Carlisle y William Nicholson (químico).
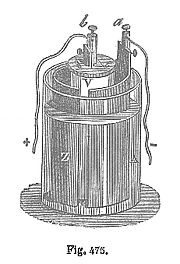
 Ilustración de una celda Daniell, hacia 1860.
Ilustración de una celda Daniell, hacia 1860.
1836 - La pila Daniell
 Representación esquemática de la célula original Daniell.
Representación esquemática de la célula original Daniell.
Un químico británico llamado John Frederic Daniell buscó una manera de eliminar el problema de las burbujas de hidrógeno que aparecen en la pila voltaica, y su solución fue utilizar un segundo electrolito para consumir el hidrógeno producido por el primero. En 1836, inventó la pila Daniell, que consistía en una vasija de cobre llena de una disolución de sulfato de cobre, en el que se sumerge un recipiente de barro sin esmaltar lleno de ácido sulfúrico y un electrodo de zinc. La barrera de barro era porosa, lo que permitía a los iones pasar a través suya, pero impedía la mezcla de las dos disoluciones. Sin esta barrera, cuando no había corriente se comprobó que los iones de cobre (II) se derivaban hacia el ánodo de zinc y sufrían la reducción sin producir una corriente, destruyendo la vida de la batería.[7]
Con el tiempo, la acumulación de cobre podría bloquear los poros de la barrera de barro y acortar la vida de la batería. Sin embargo, la celda de Daniell proporcionan una corriente mayor y más fiable que la pila voltaica, debido al depósito de cobre electrolítico en el cátodo (un conductor) en lugar de hidrógeno (un aislante). También era más segura y menos corrosiva. Tenía una tensión de funcionamiento de alrededor de 1,1 voltios. Fue ampliamente utilizada en las redes de telégrafo, hasta que fue suplantada por la pila Leclanché a finales de la década de 1860.[6]
1844 - La pila de Grove
La pila de Grove fue inventada por William Robert Grove en 1844 y es una modificación de la pila Daniell. Consistía en un ánodo de zinc sumergido en ácido sulfúrico y un cátodo de platino sumergido en ácido nítrico, separados por barro poroso. La pila de Grove proporcionaba una corriente elevada y un voltaje casi dos veces superior al de la pila Daniell, por lo que fue la favorita de las redes telegráficas de América durante un tiempo. Sin embargo, se desprendían vapores tóxicos de óxido nítrico cuando estaba en operación.[6] La tensión también se reducía considerablemente cuando la carga disminuía, lo que llegó a ser una responsabilidad cuando las redes telegráficas se hicieron más complejas. El platino también era muy caro. La pila de Grove fue sustituida por la más barata, más segura y de mejor rendimiento pila de gravedad en la década de 1860.
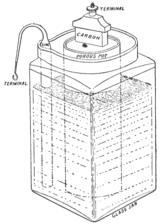
1859 - La pila de plomo-ácido: la primera batería recargable.
 Ilustración del siglo XIX de una pila de plomo-ácido de Planté.
Ilustración del siglo XIX de una pila de plomo-ácido de Planté.
Hasta este punto, todas las baterías existentes debían ser vaciadas de forma permanente cuando se agotaban los reactivos y finalizaban todas sus reacciones químicas. En 1859, Gaston Planté inventó la batería de plomo-ácido, el primer acumulador, o sea, la primera batería que puede recargarse (en realidad, regenerar las sustancias químicas gastadas) haciendo pasar una corriente en sentido inverso a través de ella. Una batería de plomo-ácido se compone de un ánodo de plomo y un cátodo de dióxido de plomo sumergidos en ácido sulfúrico. Ambos electrodos reaccionan con el ácido para producir sulfato de plomo (II), pero la reacción en el ánodo de plomo libera electrones mientras que la reacción en el óxido de plomo los capta, lo que produce una corriente. Estas reacciones químicas pueden ser revertidas mediante la aplicación de una corriente en sentido inverso, lo que permite recargarla, al igual que se de debe hacer antes de su primer uso.
El primer diseño de Planté consistía en dos placas de plomo separadas por bandas de goma y enrolladas en espiral.[8] Sus baterías se utilizaron por primera vez para alimentar la luz en los vagones del tren mientras se detenía en una estación. En 1881, Camille Alphonse Faure inventó una versión mejorada que consistía en una celosía o rejilla de plomo en la que se apelmazó una pasta de dióxido de plomo, formando una placa. Varias planchas podían apilarse para obtener un mayor rendimiento. Este diseño fue más fácil de producir en masa.
En comparación con otras baterías, el diseño de Planté era más bien pesado y voluminoso para la cantidad de energía que podría almacenar. Sin embargo, podría producir picos de corriente muy grandes. También tenía una resistencia interna muy baja, por lo que una misma batería puede usarse para alimentar múltiples circuitos.[6]
La batería de plomo aún se utiliza hoy en los automóviles y otras aplicaciones donde el peso no es un factor importante. El principio básico no ha cambiado desde 1859, aunque en la década de 1970 se desarrolló una variante que utiliza un electrolito en forma de gel en lugar de un líquido (comúnmente conocido como la batería de gel), permitiendo que la batería pueda ser utilizada en diferentes posiciones sin fallos o fugas.
Hoy en día las celdas electroquímicas se clasifican como "primarias" si producen una corriente sólo hasta que los reactivos químicos se han agotado, y "secundarias", si las reacciones químicas puede ser revertidas mediante la recarga de la célula. La batería de plomo-ácido fue, por tanto, la primera batería o celda secundaria.
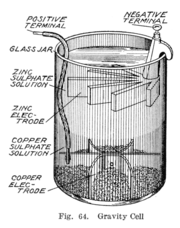
1860 - La celda de gravedad
Esta variante particular de la pila Daniell, también es conocida como celda de pata de gallo debido a la forma distintiva de uno de sus electrodos.
En algún momento durante la década de 1860, un francés con el nombre de Callaud inventó una variante de la pila Daniell llamada celda de gravedad.[6] Esta versión más simple prescindió de la barrera porosa. Esto redujo la resistencia interna del sistema y por lo tanto la batería produjo una corriente más intensa. Rápidamente se convirtió en la batería de elección para las redes telegráficas americanas y británicas, y se utilizó hasta la década de 1950.[9] En la industria del telégrafo, esta batería se montaba a menudo in situ por los propios trabajadores de telégrafos, y cuando ésta se agotaba, era renovada mediante la sustitución de los componentes consumidos.[10]
La celda de gravedad consistía de un frasco de vidrio, con un cátodo de cobre asentado en la parte inferior y un ánodo de zinc (con forma parecida a una pata de gallo), colgado por debajo del borde. Se esparcían cristales de sulfato de cobre (II) junto al cátodo, y el frasco se llenaba con agua destilada. Cuando la corriente circulaba, se formaba una capa de disolución de sulfato de zinc en la parte superior junto al ánodo. Esta capa superior se mantenía separada de la capa de sulfato de cobre del fondo por su menor densidad y por la polaridad de la célula.
La capa de sulfato de zinc era clara en contraste con el color azul profundo de la capa de sulfato de cobre, que permitía a un técnico comprobar la duración de la pila a simple vista. Por otra parte, esta configuración significaba que la batería sólo se podía utilizar en un sitio fijo, de lo contrario las disoluciones se mezclarían o se derramarían. Otro inconveniente era que tenía que estar circulando, de modo continuo, una corriente para evitar que las dos disoluciones se mezclaran por difusión, por lo que esta celda no era adecuada para un uso intermitente.
1866 - La pila Leclanché
En 1866, Georges Leclanché inventó una batería que consistía en un ánodo de zinc y un cátodo de dióxido de manganeso envueltos en un material poroso, sumergidos en un frasco de disolución de cloruro de amonio. El cátodo de dióxido de manganeso estaba mezclado con un poco de carbono que mejoraba la conductividad y la absorción de electrolitos.[11] Suministraba un voltaje de 1,4 a 1,6 voltios.[6] Esta célula consiguió un éxito muy rápido en telegrafía, señalización y timbres eléctricos. Se utilizó para alimentar los primeros teléfonos, por lo general desde una caja de madera colocada junto a la pared, antes de que los teléfonos pudieron obtener la energía de la propia línea. No podía proporcionar una corriente sostenida durante mucho tiempo. En conversaciones largas, la batería se agotaba, haciendo inaudible la conversación.[12] Esto se debía a que ciertas reacciones químicas en la célula aumentaban la resistencia interna y, por tanto, bajaba el voltaje. Estas reacciones se invertían cuando la batería se quedaba inactivo, por lo que estas pilas sólo eran adecuadas para un uso intermitente.[6]
1887 - La pila de zinc-carbono: la primera celda seca
En 1887, Carl Gassner patentó una variante de la celda Leclanché que llegó a ser conocida como la pila seca, ya que no tiene un electrolito líquido libre. En vez de eso, mezcló el cloruro de amonio con yeso de París para crear una pasta, con un poco de cloruro de zinc añadido para prolongar la vida útil. El cátodo de dióxido de manganeso se sumerge en la pasta, y ambos fueron encerrados en una carcasa de zinc, que también actuaba como ánodo.
A diferencia de las pilas húmedas, la pila seca Gassner era más sólida, no requería mantenimiento, no se derramaba y podría ser utilizado en cualquier orientación. Suministraba un potencial de 1,5 voltios. La primera pila seca producida en masa fue el modelo Columbia, comercializado por primera vez por la National Carbon Company (NCC) en 1896. Esta compañía mejoró el modelo de Gassner, sustituyendo el yeso de París por cartón en espiral, una innovación que dejaba más espacio para el cátodo y hacía que la batería fuera más fácil de montar. Fue la primera batería apropiada para el público en general e hizo prácticos los dispositivos eléctricos portátiles. La linterna se inventó ese mismo año.[13] La batería de zinc-carbono todavía se fabrica hoy en día.
Paralelamente, en 1887 Federico Guillermo Luis Hellesen desarrolló su propio diseño de pila seca. Se ha afirmado que el diseño de Hellesen precedió al de Gassner.[14]
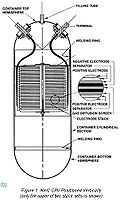
1899 - La batería de níquel-cadmio
En 1899, un científico sueco llamado Waldmar Jungner inventó la batería de níquel-cadmio, una batería recargable que tenía electrodos de níquel y cadmio en una disolución de hidróxido de potasio. Se comercializó en Suecia en 1910 y llegó a Estados Unidos en 1946. Los primeros modelos eran robustos y tenían una densidad de energía significativamente mayor que las baterías de plomo ácido, pero eran mucho más caros.
1903 - La batería de níquel-hierro
Waldmar Jungner también inventó una batería de níquel-hierro el mismo año que su batería de Ni-Cd, pero resultó ser inferior a su homóloga de cadmio y, por consiguiente, nunca se molestó en patentarla. Producía mucho más hidrógeno gaseoso cuando estaba cargada, lo que significa que no puede cerrarse, y el proceso de carga era menos eficiente (aunque era más barato).
Sin embargo, Thomas Edison recogió el diseño de la batería de níquel-hierro de Jungner, la patentó él mismo y la vendió en 1903. Edison quería comercializar un sustituto más ligero y duradero para la batería de plomo-ácido que impulsaba a algunos de los primeros automóviles, y esperaba que de esta forma los coches eléctricos se convertirían en el estándar, con su empresa como proveedor de la batería principal. Sin embargo, los clientes encontraron que su primer modelo era propenso a fugas y de corta duración de la batería, y no superaba a la batería de plomo-ácido por mucho. Aunque Edison fue capaz de producir un modelo más fiable y potente siete años más tarde, esta vez el Ford modelo T, de bajo costo y buena fiabilidad, había hecho que los autos con motor de gasolina fuesen la norma. A pesar de ello, la batería de Edison logró un gran éxito en otras aplicaciones.[15]
1955 - La batería alcalina común
Hasta finales de la década de 1950 la batería de zinc-carbono siguió siendo una popular batería de células primarias, pero la duración relativamente baja de esta batería obstaculizaba las ventas. Las primeras pilas alcalinas eran similares a la de carbono-zinc pero sustituyendo el electrolito por hidróxido de potasio (KOH). Nótese que el potasio es un metal alcalino, y de ahí recibe su nombre.
En 1955, un ingeniero que trabajaba para la empresa Eveready (ahora conocida como Energizer) llamado Lewis Urry intentaba encontrar una manera de extender la vida de las baterías de zinc-carbono, pero Urry decidió en cambio que las pilas alcalinas eran más prometedoras. Hasta ese momento, las más duraderas pilas alcalinas eran inviablemente caras. La batería de Urry se componía de un cátodo de dióxido de manganeso y un ánodo de zinc en polvo con un electrolito alcalino.[16] A base de zinc en polvo se dotó al ánodo de una mayor superficie. Estas baterías salieron al mercado en 1959.
Las pilas alcalinas primarias son más caras pero son capaces de descargarse proporcionando corrientes elevadas y manteniendo el rendimiento. Las pilas secundarias (recargables) son más baratas que las de níquel-cadmio, tienen buena retención de carga y trabajan en un amplio margen de temperaturas.
Pila alcalina Pila de óxido de plata Pila de Litio-Manganeso 

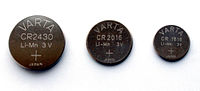
Modelo LR44 o AG13, de 3 voltios Diversos modelos (SR44, etc) Modelos CR de diferentes tamaños. Pila de mercurio
La pila de zinc-óxido de mercurio (II) es conocida normalmente como pila de mercurio o pila de botón porque suele tener forma de disco pequeño. Se utiliza en audífonos, células fotoeléctricas y relojes de pulsera eléctricos. El electrodo negativo es de cinc, el electrodo positivo de óxido de mercurio (II) y el electrólito es una disolución de hidróxido de potasio. La batería de mercurio produce 1,34 V, aproximadamente.[16]
Son muy tóxicas y perjudiciales para el ambiente, por contener hasta un 30% de mercurio. Debido a su toxicidad, ya no está permitida su comercialización,aunque se emplean como celdas de referencia para comparar con las demás pilas.
Pila de óxido de plata
La pila de óxido de plata es parecida a la pila de mercurio, cambiando el óxido de mercurio por óxido de plata, y suministra 1,5 voltios. Sirven para corrientes pequeñas (relojes, etc).[16] Tiene buena relación energía-peso y pobres respuestas a baja temperatura. Contienen un 1% de mercurio.
Años 1970 - La pila de níquel e hidrógeno
La pila de níquel hidrógeno entró en el mercado como un subsistema de almacenamiento de energía para satélites de comunicaciones comerciales.[17] [18] utiliza celdas de hidrógeno presurizado a más de 1.200 psi (82,7 bar]) Las aleaciones de niquel pueden disolver o liberar hidrógeno reversiblemente y de modo proporcional a cambios en la presión y temperatura. Este hidrógeno se oxidaría en el ánodo. Se ha especulado que este tipo de pila podría reemplazar a las de níquel-cadmio para algunos usos.
Las reacciones electroquímicas implicadas en este generador son más complejas que en otros tipos de pilas. El hidrógeno es oxidado hasta formar agua sobre electrodos de níquel sinterizado poroso, mientras el agua es oxidada.[19]
Fines de 1980 - El acumulador de níquel metal hidruro
Las primeras pilas recargables de níquel metal hidruro (NiMH) de grado consumidor para pequeños usos aparecieron en el mercado en 1989 como una variante de la batería de níquel-hidrógeno de la década de 1970.[20] Las baterías de NiMH tienden a tener mayor longevidad que las baterías de Ni-Cd (y sus esperanzas de vida siguen aumentando a medida que los fabricantes experimentan con nuevas aleaciones) y, dado que el cadmio es tóxico, las baterías de NiMH son menos perjudiciales para el medio ambiente.
Años 1970 - Pila de litio
El litio es el metal con menor densidad y tiene el mayor potencial electroquímico y el mayor cociente energía-peso, así que en teoría, sería un material ideal para que puedan fabricar pilas y baterías. No se puede emplear un electrolito acuoso pues reaccionaría con el litio. La experimentación con pilas de litio comenzó en 1912 con G. N. Lewis, y en la década de 1970 se vendieron las primeras baterías de litio. Se emplean actualmente diversas pilas con litio en el ánodo y diferentes sustancias en el cátodo:
- pila de litio y sulfuro de hierro (1,6 voltios). Son de pequeño tamaño y bajo coste.
- pila de litio y dióxido de manganeso (unos 3 voltios). Similares a las anteriores.
- pila de litio y dióxido de azufre. El cátodo en este caso es gaseoso. Se emplea para aplicaciones militares.
- pila de litio y cloruro de tionilo. Trabajan a muy bajas temperaturas pero su uso debe ser cuidadoso por su toxicidad.
- pila de litio y monofluoruro de carbono (unos 3,2 voltios). Se emplea para pequeños dispositivos como cámaras.
Años 1990 - Acumulador de ion litio
En la década de 1980, el químico estadounidense John B. Goodenough dirigió un equipo de investigación de Sony que produciría finalmente la batería de iones de litio, recargable y una versión más estable de la batería de litio (el litio puro reaccionaba violentamente al contacto con un medio acuoso). Las primeras unidades se vendieron en 1991. En estas baterías es importante controlar los procesos de carga y descarga, ya que por encima de 60 grados Celsius pueden explotar.
El cátodo suele ser un óxido de cobalto y litio, mientras que el ánodo se compone de carbono poroso. Este ánodo es bastante caro, por lo que se están estudiando alternativas con níquel, manganeso, o combinaciones de estos metales junto a iones aluminio o cromo,[21]
En 1996, se lanzó al mercado la batería de polímero de ion de litio. Estas baterías alojan su electrolito en un polímero sólido compuesto en lugar de en un disolvente líquido, y los electrodos y los separadores se laminan entre sí. Esta última diferencia permite que la batería pueda quedar encerrada en una envoltura flexible en lugar de una carcasa metálica rígida, lo que significa que este tipo de baterías puede ser fabricado específicamente para adaptarse a un dispositivo en particular. También tienen una densidad de energía mayor que las baterías de iones de litio normal. Estas ventajas la han convertido en una batería de elección para los dispositivos electrónicos portátiles, como teléfonos móviles y PDAs, ya que permiten un diseño más flexible y compacto.
Pila de zinc-aire
 Cuatro pilas zinc-aire, como las PR44, empleadas para alimentar los audífonos.
Cuatro pilas zinc-aire, como las PR44, empleadas para alimentar los audífonos.
Se las distingue por tener unos pequeños orificios en una de sus caras. Suministran un voltaje constante durante toda su vida operativa y por ello son muy adecuadas para diversas aplicaciones médicas y de comunicaciones.
Poseen una lengüeta de plástico colocada en la fábrica que cierra los orificios de toma de aire de la pila hasta que vaya a ser utilizada. No se debe retirar esa lengüeta antes de su uso. Para activar la pila, simplemente se retira la lengüeta y se espera un minuto para que el aire entre y active los ingredientes.
Véase también
Enlaces externos
- "Elementos de Física". Eduardo Lozano y Ponce de León. Madrid, 1907.
- Libro décimo - Electricidad dinámica. Capítulo primero: Pila voltaica; sus modificaciones. En: Tratado elemental de física experimental y aplicada y de meteorología con numerosa colección de problemas. A. Ganot. Ed. Carlos Bailly-Bailliere. Madrid, 1862.
- Pilas y acumuladores, máquinas de corriente continua. Enciclopedia CEAC de electricidad. José Ramírez Vázquez, Amadeo Domingo Forcada. CEAC, 1981. ISBN: 8432960020
Notas y referencias
- ↑ Origen, progresos y estado actual de toda la literatura. Juan de Andrés. Verbum Editorial, 2001, ISBN: 847962115X, pág. 824
- ↑ Corder, Gregory, "Using an Unconventional History of the Battery to engage students and explore the importance of evidence", Virginia Journal of Science Education 1
- ↑ Origin of Electrical Power, National Museum of American History; Último acceso: 2 Ene, 2007
- ↑ Institute and Museum of the History of Science. «Trough Battery». Consultado el 15-01-2007.
- ↑ Volta and the "Pile", Case Western Reserve University; Last accessed on Jan 2, 2007
- ↑ a b c d e f g James B. Calvert. «The Electromagnetic Telegraph».
- ↑ Giorgio Carboni, Experiments in Electrochemistry; Last accessed on Feb 22, 2007.
- ↑ http://www.corrosion-doctors.org/Biographies/PlantelBio.htm, Corrosion-doctors.org; Last accessed on Jan 3, 2007
- ↑ Tools of Telegraphy, Telegraph Lore; Last accessed Jan 9, 2007
- ↑ Gregory S. Raven, Recollections of a Narrow Gauge Lightning Slinger
- ↑ Zinc-Carbon Batteries, Molecular Expressions; Último acceso Jan 9, 2007
- ↑ Battery Facts. «Leclanché Cell».
- ↑ The Columbia Dry Cell Battery, American Chemical Society; Último acceso: 9 Enero, 2007
- ↑ Energi på dåse, Jytte Thorndahl; Último acceso: 26 Junio, 2007
- ↑ IEEE Virtual Museum. «Edison's Alkaline Battery». Consultado el 10-01-2007.
- ↑ a b c Electricidad: principios y aplicaciones. Richard J. Fowler. Editorial Reverté, 1994. ISBN: 8429130284. Pág. 67
- ↑ A nickel/hydrogen battery for PV systems
- ↑ Nickel-Hydrogen Battery Technology—Development and Status
- ↑ Diccionario de ciencias. Diccionarios Oxford-Complutense. Domingo Agustín Vázquez. Editorial Complutense, 2000. ISBN: 8489784809.Pág. 787
- ↑ In search of the perfect battery
- ↑ battery. (2010). En: Encyclopædia Britannica. Último acceso: 07 marzo, 2010, de [Encyclopædia Britannica Online: http://www.britannica.com/EBchecked/topic/56126/battery]
Categorías:- Baterías
- Historia de la física
Wikimedia foundation. 2010.