- Trióxido de cromo
-
Trióxido de cromo

Nombre (IUPAC) sistemático Trióxido de cromo General Otros nombres Óxido de cromo (VI)
anhídrido crómico (obsoleto)
ácido crómico (erróneo)Fórmula molecular CrO3 Identificadores Número CAS 1333-82-0 PubChem ChemSpider 14212 ChEBI 48240 Número RTECS GB6650000 Propiedades físicas Estado de agregación sólido Apariencia rojo oscuro, granular, inodoro Densidad 2700 kg/m3; 2,70 g/cm3 Masa molar 99,994 g/mol Punto de fusión 470 K (196,85 °C) Punto de ebullición 524 K (250,85 °C) Propiedades químicas Solubilidad en agua 61,7 g/100 mL (0 °C)
63 g/100 mL (25 °C)
67 g/100 mL (100 °C)Solubilidad en metanol soluble en ácido sulfúrico, ácido nítrico Peligrosidad NFPA 704 Frases R R45, R46, R9, R24/25, R26, R35, R42/43, R48/23, R62, R50/53 Frases S S53, S45, S60, S61 Número RTECS GB6650000 Riesgos Oxidante (O)
Carcinógeno Cat. 1
Mutágeno Cat. 2
Repr. Cat. 3
Muy tóxico (T+)
Peligroso para el medio ambiente (N)Ingestión Calambres abdominales.[1] Inhalación Tos. Dificultad respiratoria. Jadeo. Dolor de garganta. Sibilancia. Piel Enrojecimiento. Quemaduras cutáneas. Dolor. Ojos Enrojecimiento. Dolor. Pérdida de visión permanente. Quemaduras profundas graves. LD50 80 mg/kg Más información ICSC 1194 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl trióxido de cromo, también llamado óxido de cromo (VI), es un compuesto inorgánico de fórmula CrO3. Es un anhídrido ácido del ácido crómico, y en ocasiones se comercializa bajo el mismo nombre.[2]
Este compuesto es un sólido de color rojo oscuro/naranja apagado, que se disuelve en el agua sufriendo hidrólisis concomitante. Millones de kilos son producidos anualmente, principalmente a través de galvanoplastia.[3]
Contenido
Producción, estructura y reacciones básicas
El trióxido de cromo es sintetizado por tratamiento de cromato de sodio o el correspondiente dicromato de sodio con ácido sulfúrico:[2]
- H2SO4 + Na2CrO4 → CrO3 + Na2SO4 + H2O
Cada año se producen unos 100 millones de kg por estas rutas o similares.[3]
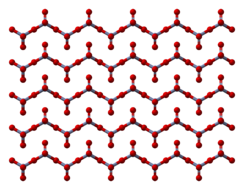
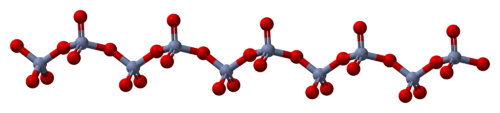
El sólido está formado por cadenas de átomos de cromo con coordinación tetraédrica, que comparten vértices. Cada átomo de cromo, por lo tanto, tienen dos átomos de oxígeno vecinos. Otros dos átomos de oxígeno no son compartidos, dando una estequiometría total de 1:3[4] [5]
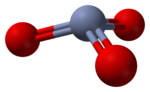
La estructura del monómero CrO3 se ha calculado utilizando teoría del funcional de la densidad, y se prevé que sea piramidal (grupo puntual C3v) en lugar de plana (grupo puntual D3h).[6]
El trióxido de cromo se descompone por encima de 197 °C liberando oxígeno y produciendo síntesis orgánica como un oxidante, a menudo en forma de disolución en ácido acético,[4] o acetona como en el caso de la oxidación de Jones. En estas oxidaciones, el Cr (VI) convierte 1,5 equivalentes de alcoholes en sus correspondientes aldehídos o cetonas:
- 2 CrO3 + 3 RCH2OH → Cr2O3 + 3 RCHO + 3 H2O
Aplicaciones
El trióxido de cromo se utiliza principalmente en el cromado de objetos. Normalmente se emplea con los aditivos que afectan el proceso de galvanizado, pero no reaccionan con el trióxido. El trióxido reacciona con el cadmio, el zinc y otros metales para generar películas de pasivación de cromato que se resisten la corrosión. También se utiliza en la producción de rubíes sintéticos.
Seguridad
El trióxido de cromo es altamente tóxico, corrosivo y cancerígeno.[7] Es el principal ejemplo de compuesto de cromo hexavalente, que supone un riesgo ambiental. Los derivados de cromo (III) no son particularmente peligrosos, por lo que se utilizan reductores para destruir las muestras de cromo (VI).
Por contacto con trióxido de cromo, que es un oxidante potente, entran en ignición algunos materiales orgánicos (por ejemplo, etanol).
Referencias
- ↑ Trióxido de cromo. Fichas de seguridad. Grupo Prevenir
- ↑ a b «Chromium Trioxide». Chemicalland21.
- ↑ a b Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinge. Chromium Compounds. in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, 2002. doi 10.1002/14356007.a07_067
- ↑ a b Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6ª ed.), Nueva York: Wiley-Interscience, ISBN 0-471-19957-5 ^ Stephens, J. S.; Cruickshank, D. W. J. (1970). "The crystal structure of (CrO3)∞". Acta Cryst. B 26: 222–226. doi:10.1107/S0567740870002182.
- ↑ «The crystal structure of (CrO3)∞». Acta Cryst. B 26: pp. 222–226. 1970. doi:.
- ↑ «Probing the Electronic and Structural Properties of Chromium Oxide Clusters (CrO3)n− and (CrO3)n (n = 1–5): Photoelectron Spectroscopy and Density Functional Calculations». J. Am. Chem. Soc. 130 (15): pp. 5167–5177. 2008. doi:.
- ↑ «Chromium Trioxide (MSDS)». J. T. Baker. Consultado el 2007-09-13.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Trióxido de cromo. Commons
Wikimedia Commons alberga contenido multimedia sobre Trióxido de cromo. Commons- Trióxido de cromo. Fichas internacionales de seguridad química. Grupo Prevenir
- Trióxido de cromo. Cosmos online
- ATSDR Estudios de casos en Medicina Ambiental: Toxicidad del cromo. (en inglés) Departamento de Salud y Servicios Humanos
- http://www.gemstonebuzz.com/flame-fusion
Categorías:- Óxidos
- Compuestos de cromo
Wikimedia foundation. 2010.