- Valoración redox
-
 En una valoración redox se añade una de las disoluciones gota a gota desde una bureta sobre la otra disolución (matraz Erlenmeyer, hasta que se produce un cambio de color.
En una valoración redox se añade una de las disoluciones gota a gota desde una bureta sobre la otra disolución (matraz Erlenmeyer, hasta que se produce un cambio de color.
Una valoración redox (también llamada volumetría redox, titulación redox o valoración de oxidación-reducción) es una técnica o método analítico muy usada, que permite conocer la concentración de una disolución de una sustancia que pueda actuar como oxidante o reductor.[1] Es un tipo de valoración basada en una reacción redox entre el analito (la sustancia cuya concentración queremos conocer) y la sustancia valorante. El nombre volumetría hace referencia a la medida del volumen de las disoluciones empleadas, que nos permite calcular la concentración buscada.
En una valoración redox a veces es necesario el uso de un indicador redox que sufra un cambio de color y/o de un potenciómetro para conocer el punto final. En otros casos las propias sustancias que intervienen experimentan un cambio de color que permite saber cuando se ha alcanzado ese punto de equivalencia entre el número de mols de oxidante y de reductor, como ocurre en las iodometrías o permanganometrías.
Método y material empleado
En otras valoraciones o volumetrías, (ácido-base, complexometría, de precipitación) se registra la concentración de una sustancia en función del volumen de sustancia valorante añadida, para determinar el punto final.
En una valoración redox se prefiere medir el potencial eléctrico (en voltios) como una medida de cómo transcurre la transferencia de electrones entre el reductor y el oxidante. Para ello se emplean electrodos específicos conectados a un potenciómetro. Cerca del punto de equivalencia o punto final de la valoración se observa un cambio muy brusco de dicho potencial.
Para la determinación experimental se utilizan: buretas, matraces, vasos de precipitados, probetas, pipetas, etc.
Curvas de valoración
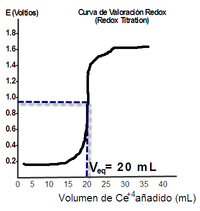
Si representamos el potencial eléctrico medido por un electrodo en función del volumen añadido de sustancia valorante se obtienen curvas de valoración o curvas de titulación, similares a la de la figura. Se observa el rápido cambio del potencial para un volumen determinado. El punto de inflexión de esta curva se llama punto de equivalencia y su volumen nos indica el volumen de sustancia valorante consumido para reaccionar con el analito.
En ausencia de sistema medidor del potencial,se pueden usar indicadores redox, sustancias que mediante un cambio de color nos indican que se ha llegado al punto de equivalencia.
Cálculos
Se debe cumplir en cualquier valoración redox la siguiente expresión:

donde:






Ejemplo: Queremos valorar 25 ml de disolución de ion Fe2+ (concentración desconocida), empleando disolución de Ce4+ 0,35 mol/L, según la ecuación:
Fe2+ + Ce4+ → Fe3+ + Ce3+.
El volumen de esta última disolución en el punto de equivalencia (ver gráfico) ha sido de 20 mL. Luego:
Vox · Mox · nº e- ganados = Vred · Mred · nº e- perdidos
20 mL · 0,35 mol/L · 1 = 25 mL · Mred · 1 ; Mred=0,28 mol/L
Clases de valoración redox
Se pueden clasificar en dos grandes grupos: oxidimetrías, en las que la sustancia valorante es un agente oxidante; y reductometrías, menos frecuentes, empleando un agente reductor para tal fin.
Oxidimetrías
El agente oxidante puede ser yodo o cualquier sal que contenga los iones permanganato, dicromato, bromato, yodato o cerio (IV).[2]
- Permanganometría: La reacción se realiza en medio ácido y posiblemente es la más utilizada. El cambio de color del ion permanganato (violeta) a ion manganeso (II) hace innecesario el uso de indicador redox, aunque podría usarse ferroína. Debido a problemas de estabilidad (forma MnO2), es necesario estandarizar dichas disoluciones antes de usarlas. Así se pueden valorar disoluciones de ácido arsenioso, ácido oxálico y otros compuestos orgánicos, peróxido de hidrógeno (agua oxigenada), nitritos o los iones manganeso (II), molibdeno (III), antimonio (III) y hierro (II), como en:[3]

- Valoración Redox del ion permanganato (E.O..: +7) con el ion hierro (II).
- Yodimetría: El yodo es un oxidante medio y permite valorar sustancias como los tiosulfatos o arsenitos,[1] mientras se reduce a ion yoduro. Otras sustancias que pueden valorarse con yodo son los sulfitos, sulfuros, y los iones arsénico (III), estaño (II) y cobre (I). Sólo es estable si se adicionan yoduros,por formación de I3-.

- Reacción entre ion tiosulfato y yodo (E.O.: 0) para dar ion tetrationato e ion yoduro (E.O.: -1)
-
- Método de Winkler: es una variante que permite medir la cantidad de oxígeno disuelto en agua.
- Cerimetría: En medio ácido, las sales de cerio (IV) tienen carácter oxidante fuerte y se reducen a ion cerio (III), ganando un sólo electrón. La simplicidad de esta reacción la hace muy interesante para múltiples valoraciones.[1]

- Oxidación del ion hierro (II) con el ion cerio (IV).
- Bromatometría: El agente oxidante es el ion bromato que se reduce a bromo, en medio ácido. Un ejemplo es:

- Sinproporcionación entre ion bromato (estado de oxidación: +5) e ion bromuro (E.O.: -1) para dar bromo (E.O.: 0)
- Dicromatometría: El agente oxidante es el ion dicromato, Cr2O72- que se reduce a cromo (III), en medio ácido.[4] Se emplea para valorar disoluciones de hierro (II), sodio o uranio. Sus disoluciones son muy estables. Se emplea difenilaminosulfonato de bario como indicador. Un ejemplo es:

- Valoración de hierro (II) con dicromato (E.O.: +6) en medio ácido: para dar hierro (III) y cromo (III)
- Iodatometría: Las disoluciones de ion yodato son muy estables y no necesitan estandarización pero dicho ion puede reducirse a catión yodo (I), I+, a yodo, I2, o a yoduro, I-.[5] Se emplea para estandarizar disoluciones de tiosulfato. El yodato reacciona con yoduros para formar yodo que sirve para valorar el tiosulfato.

- Reacción de yodato (E.O.:+5) con yoduro (E.O.:-1) en medio ácido para dar yodo (E.O.:0)

- Valoración de tiosulfato con el yodo formado en la etapa anterior.
Reductimetrías
La sustancia valorante es ahora un agente reductor, como los iones tiosulfato, yoduro o hierro (II). Son menos empleadas que las oxidimetrías.
 Disolución acuosa de dicromato de potasio.
Disolución acuosa de dicromato de potasio.
Reductimetría con tiosulfatos
El reductor más empleado es el tiosulfato y se emplea sobre todo para valorar el yodo. En la mayoría de las aplicaciones que usan esta reacción no se hacen reaccionar los oxidantes directamente con el tiosulfato. Los oxidantes reaccionan con yoduros para formar yodo, que posteriormente se valora con tiosulfato, en una valoración indirecta llamada yodometría. No confundir la yodimetría (valoración directa de un reductor con yodo) con la yodometría (valoración del yodo con un reductor).
Valoración indirecta con yoduros
Muchas sustancias son capaces de oxidar al ion yoduro a yodo. Posteriormente este yodo formado se valora con disolución de tiosulfato. Tras los cálculos correspondientes a esta valoración, conoceremos la cantidad de yodo formada y, a partir de ella, la cantidad de sustancia de concentración desconocida que sirvió para oxidar al ion yoduro.[2]

- Reacción entre yoduro (E.O.:-1) y un oxidante que queremos valorar, en medio ácido para dar yodo (E.O.:0)

- Valoración del yodo formado con tiosulfato.
Reductimetría con sal de Mohr
La sal de Mohr contiene Fe^{2+} en forma de una sal doble, sulfato de hierro (II) y amonio hexahidratado, cuya fórmula es Fe(NH4)2(SO4)2·6H2O. Son poco estables y deben estandarizarse con dicromato.
Indicadores redox
Un indicador es una sustancia que sufre un cambio de color al mismo tiempo que se llega al punto de equivalencia de una valoración redox por lo que sirven para indicar dicho punto. Pueden ser:
- Generales: Son oxidantes o reductores que sufren una reacción redox con cambio de color cuando se produce el cambio rápido de potencial, al llegar al punto de equivalencia. (Ver Curvas de valoración)
El cambio de color se produce con una variación de potencial de 0,1 voltios, cerca de su potencial de reducción.[2] Tenemos:
-
- Sal férrica de la 1,10-ortofenantrolina: Su potencial de reducción es Eo=1,06 V. Cambia de color azul pálido a rojo cuando se reduce. En forma reducida se llama ferroína.
- Ácido difenilaminosulfónico: Cambia de incoloro a verde y posteriormente a violeta, dependiendo del pH, en las cercanías de Eo=0,80 V. Se emplea para valorar Fe2+ con dicromato.
- Específicos: Reaccionan de forma específica con alguna sustancia en la reacción redox y dicha reacción suele implicar un cambio de color fácil de detectar. Es el caso del almidón que forma un complejo de color azul con las disoluciones de yodo/yoduro, I3-. Así que dependiendo de si la valoración es directa o indirecta, el color azul desaparece o aparece indicando el punto de equivalencia.
Estandarización de disoluciones para valoración
Sustancia valorante Patrón primario Permanganato, MnO4- Oxalato sódico
Ácido oxálico
Óxido de arsenio (III)Cerio (IV), Ce4+ Ídem Dicromato, Cr2O72- No necesita Yodo (en realidad, I3-) Óxido de arsenio (III), As2O3 Iodato, IO3- No necesita Tiosulfato, S2O32- Yodo liberado en
reacción dicromato + yoduroSal de Mohr Dicromato Las disoluciones de las sustancias valorantes deben ser estandarizadas antes de su empleo como sustancias valorantes, es decir, su concentración debe ser medida experimentalmente frente a una sustancia que actúa como patrón primario, y no sólo calculada a partir de la masa empleada para la disolución.[6]
Esto es necesario porque dichas sustancias no son completamente puras, pueden sufrir alteraciones en el proceso de disolución, o posteriormente durante con el tiempo transcurrido.
Algunas disoluciones sí son estables como las de dicromato o yodato por lo que se emplean como patrón primario para valorar o estandarizar a otras. En cambio otras necesitan ser normalizadas o estandarizadas frente a un patrón primario. El permanganato se estandariza con oxalato sódico según la reacción:
Ejemplo: Determinación de la cantidad de resorcinol por yodometría
Un ejemplo de una valoración redox es el tratamiento de una solución de yodo con un agente reductor y el uso de almidón como indicador. El yodo forma un complejo con el almidón de color intensamente azul. El ion yodo (II) (I2+) puede reducirse a ion yoduro (I-) por la acción, por ejemplo, del ion tiosulfato (S2O32-), y cuando todo el yodo se consume, el color azul desaparece. Esto se llama una valoración yodométrica o yodometría.
Muy a menudo la reducción de yodo a yoduro es el último paso de una serie de reacciones. Las primeras reacciones se utilizan para convertir una cantidad desconocida del analito (la sustancia que se quiere analizar) a una cantidad equivalente de yodo, que puede entonces ser valorada. A veces, otros halógenos distintos del yodo se utilizan en las reacciones intermedias porque están disponibles en disoluciones de referencia más fácilmente medibles y/o reaccionan más rápidamente con el analito. Estos pasos adicionales en una valoración yodométrica puede valer la pena porque el punto de equivalencia, donde el azul se decolora, es más claramente visible que otros métodos de análisis.
Veamos una serie de reacciones en disolución acuosa donde el resorcinol es el analito; el bromato es la referencia para estandarizar la disolución; el tiosulfato es el valorante; y el almidón actúa como indicador. Los números de oxidación se indican entre paréntesis.

El ion bromato reacciona con exceso de bromuro en disolución ácida para dar bromo y agua. El bromo obtenido se emplea en la etapa siguiente ii.
El bromo reacciona con resorcinol (hasta que éste se agota) para dar bromuro de hidrógeno y tribromoresorcinol. El bromo que no ha reaccionado (por estar en exceso) sigue en la etapa iii.
Todo el bromo sobrante reacciona con exceso de yoduro para dar bromuro de yodo. El yodo que ha sobrado sigue en la etapa iv.
Finalmente, el yodo sobrante de la etapa anterior reacciona con tiosulfato para dar yoduro y tetrationato.
Llamemos a las cantidades iniciales de las diferentes sustancias con una letra (todas las cantidades están en mol o en mol/L):
- resorcina → R (desconocida)
- bromato → B,
- tiosulfato → T,
donde B o T son conocidas de antemano y R es el valor desconocido que queremos calcular. Hemos que asegurarnos de que R es inferior a B. La cantidad de moles de resorcinol en la muestra inicial es igual a R = B - T/6
Titulaciones amperométricas
En una titulación amperométrica, a diferencia de las anteriores, no se mide el potencial mediante un electrodo adecuado sino que, dejando el potencial fijo, se mide el valor de la intensidad de corriente que circula entre dos puntos. En el punto de equivalencia ocurrirá un brusco cambio en el valor de la corriente.[7] Las titulaciones amperométricas se pueden realizar de dos modos:
- Empleando dos electrodos (detección biamperométrica): se introducen dos electrodos idénticos en la disolución. con una diferencia de potencial constante y se mide el valor de la corriente que pasa entre ellos.
- Empleando un solo electrodo: Es necesario un potenciostato y el empleo de electrodo de referencia.
En la técnica potenciométrica (medida del potencial) la relación con la concentración es logarítmica, y en este caso se mide la intensidad de corriente que tiene una relación directa con la concentración.
Referencias
- ↑ a b c Cap. 5: Valoraciones de oxidación-reducción. En: Curso de Análisis farmacéutico: Ensayo del medicamento. Kenneth A. Connors. Editorial Reverté, 1981. ISBN: 8429171134. Pág. 105
- ↑ a b c Volumetrías Redox. Departamento de Química Física y Analítica. Universidad de Oviedo.
- ↑ Química analítica moderna. William F. Pickering. Editorial Reverté, 1980. ISBN 8429174710. Pág. 434
- ↑ Dicromatometría. Manual de laboratorio. Química Analítica II. Elizabeth Arancibia Araya. Universidad de la Serena. Último acceso: 9-febrero-2010
- ↑ Cap. XI: Oxidantes y reductores empleados en análisis cuantitativo. Química cuantitativa. Glenn Brown. Editorial Reverté, 1977. ISBN: 8429170804. Pág.320
- ↑ Estandarización de disoluciones valorantes. José Morillo Aguado. Deptº de Ingeniería Química y Ambiental. Escuela Técnica Superior de Ingenieros de Sevilla. Universidad de Sevilla.
- ↑ Amperometría. Química Analítica 2: Electroquímica. Fac.de Ciencias Exactas y Naturales. Universidad de Antioquía. Colombia.
Véase también
- Análisis volumétrico
- Valoración
- Reducción-oxidación
- Agente oxidante
- Agente reductor
- Indicador redox
Enlaces externos
- Cap. XI: Oxidantes y reductores empleados en análisis cuantitativo. Química cuantitativa. Glenn Brown. Editorial Reverté, 1977. ISBN: 8429170804. Pág.320
Categorías:- Reacciones redox
- Equilibrio químico
- Análisis volumétrico
- Química analítica
Wikimedia foundation. 2010.