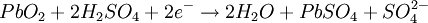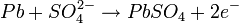- Batería de plomo y ácido
-
Batería de plomo y ácido
Las baterías de plomo son un tipo de batería muy común en vehículos convencionales, no híbridos.
Suelen dar 6, 12 u otro múltiplo, pero la tensión que suministra cada celda es de 2 V. Tienen una gran capacidad de corriente que las hacen ideales para los motores de arranque.
Su forma más conocida son las baterías de automóvil. Están formadas por un depósito de ácido sulfúrico y dentro de él una serie de placas de plomo dispuestas alternadamente. Para evitar la combadura de las placas positivas, se dispone una negativa adicional, de forma que siempre haya una placa negativa exterior. Generalmente, en su fabricación, las placas positivas están recubiertas o impregnadas de dióxido de plomo (PbO2), y las negativas están formadas por plomo esponjoso. Este estado inicial corresponde a la batería cargada, así que el electrolito agregado inicialmente debe corresponder a la batería con carga completa (densidad 1.280 g/ml). Según el número de placas, la corriente (intensidad) suministrada será mayor o menor. Debajo de las placas se deja un espacio para que se depositen eventuales desprendimientos de los materiales que forman las placas. Para que no haya contacto eléctrico directo entre placas positivas y negativas, se disponen separadores aislantes que deben ser resistentes al ácido y permitir la libre circulación del electrolito.
El Acumulador de plomo está constituido por dos tipos de electrodos de plomo que, cuando el aparato está descargado, se encuentra en forma de sulfato de plomo (PbSO4 II) incrustado en una matriz de plomo metálico (Pb); el electrolito es una disolución de ácido sulfúrico. Esta dilución en agua es tal que su densidad es de 1.280 +/– 0.010 g/ml con carga plena, y bajará a 1.100 g/ml cuando la batería esté descargada. Este tipo de acumulador se usa en muchas aplicaciones, además de los automóviles. Su funcionamiento es el siguiente:
Durante el proceso de carga inicial el sulfato de plomo (II) es reducido a plomo metal en el polo negativo, mientras que en el ánodo se forma óxido de plomo (IV) (PbO2). Por lo tanto se trata de un proceso de dismutación. No se libera hidrógeno, ya que la reducción de los protones a hidrógeno elemental está cinéticamente impedida en una superficie de plomo, característica favorable que se refuerza incorporando a los electrodos pequeñas cantidades de plata. El desprendimiento de hidrógeno provocaría la lenta degradación del electrodo, ayudando a que se desmoronasen mecánicamente partes del mismo, alteraciones irreversibles que acortan la duración del acumulador. Sólo si se supera la tensión de carga recomendada se libera hidrógeno, se consume el agua del electrolito y se acorta la vida de las placas, con el consiguiente peligro de explosión por la combustibilidad del hidrógeno. Durante la descarga se invierten los procesos de la carga. El óxido de plomo (IV) es reducido a sulfato de plomo (II) mientras que el plomo elemental es oxidado para dar igualmente sulfato de plomo (II). Los electrones intercambiados se aprovechan en forma de corriente eléctrica por un circuito externo. Los procesos elementales que trascurren son los siguientes:
En la descarga baja la concentración del ácido sulfúrico porque se crea sulfato de plomo y aumenta la cantidad de agua liberada en la reacción. Como el ácido sulfúrico concentrado tiene una densidad superior al ácido sulfúrico diluido, la densidad del ácido puede servir de indicador para el estado de carga del dispositivo.
No obstante, este proceso no se puede repetir indefinidamente porque, cuando el sulfato de plomo forma cristales muy grandes, ya no responden bien a los procesos indicados, con lo que se pierde la característica esencial de la reversibilidad. Se dice entonces que el acumulador se ha sulfatado y es necesario sustituirlo por otro nuevo. Los cristales grandes también se forman si se deja caer por debajo de 1.8 V la tensión de cada celda.
Muchos acumuladores de este tipo que se venden actualmente utilizan un electrolito en pasta, que no se evapora y hace mucho más segura y cómoda su utilización.
Tensiones de uso normal
Estos son rangos generales de voltaje para baterías de 6 celdas Pb-ácido:
- Circuito abierto (inactivo) a plena carga: 12.6 V ~ 12.8 V (2.10-2.13V por celda).
- Circuito abierto a plena descarga: 11.8 V ~ 12.0 V.
- Cargado a plena descarga: 10.5 V.
- Carga continua de preservación (flotación): 13.4 V para electrolito de gel; 13.5 V for AGM (absorbed glass mat) y13.8 V para celdas de electrolito fluido común.
- Todos los voltajes están referenciados a 20 °C, y deben ajustarse -0.022V/°C por cambios en la temperatura.
- Las recomendaciones sobre el voltaje de flotación varían, de acuerdo con las recomendaciones del fabricante.
- Una tensión de flotación precisa (±0.05 V) es crítica respecto a la longevidad; muy baja (sulfatación) es casi tan mala como muy alta (corrosión y pérdida de electrolito)
- Carga típica (diaria): 14.2 V a 14.5 V (dependiendo de las recomendaciones del fabricante)
- Carga de ecualización (baterías de electrolito fluido): 15 V por no mas de 2 horas. La temperatura de la batería debe controlarse.
- Umbral de gaseado: 14.4 V.
- Después de plena carga la tensión de terminales caerá rápidamente a 13.2 V y luego lentamente a 12.6 V.
Enlaces externos
Categorías: Baterías | Tecnologías del automóvil
Wikimedia foundation. 2010.