- Calor específico
-
Calor específico
El calor específico de una sustancia o sistema termodinámico es una magnitud física que se define como la cantidad de calor que hay que suministrar a la unidad de masa del sistema considerado para elevar su temperatura en una unidad (kelvin o grado Celsius) a partir de una temperatura dada; en general, el valor del calor específico depende de dicha temperatura inicial.[1] [2] Se la representa con la letra
 (minúscula).
(minúscula).En forma análoga, se define la capacidad calorífica de una sustancia o sistema termodinámico como la cantidad de calor que hay que suministrarle para elevar su temperatura en una unidad kelvin o grado Celsius) a partir de una temperatura dada. Se la representa con la letra
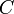 (mayúscula).
(mayúscula).Obviamente, el calor específico es la capacidad calorífica específica, esto es
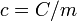 .[3]
.[3]Contenido
Introducción
El calor específico es una propiedad intensiva de la materia, por lo que es representativa de cada sustancia; por el contrario, la capacidad calorífica es una propiedad extensiva representativa de cada cuerpo o sistema particular.[4]
Cuanto mayor es el calor específico de las sustancias, más energía calorífica se necesita para incrementar la temperatura. Por ejemplo, se requiere ocho veces más energía para incrementar la temperatura de un lingote de magnesio que para un lingote de plomo de la misma masa.[1]
El término "calor específico" tiene su origen en el trabajo del físico Joseph Black quien realizó variadas medidas calorimétricas y usó la frase “capacidad para el calor”.[5] En esa época la mecánica y la termodinámica se consideraban ciencias independientes, por lo que actualmente el término podría parecer inapropiado, tal vez un mejor nombre podría ser transferencia de energía calorífica específica, pero el término está demasiado arraigado para ser reemplazado.[6]
Ecuaciones básicas
El calor específico medio (
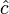 ) correspondiente a un cierto intervalo de temperaturas
) correspondiente a un cierto intervalo de temperaturas 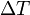 se define en la forma:
se define en la forma: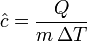
donde
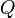 es la transferencia de energía en forma calorífica entre el sistema y su entorno u otro sistema,
es la transferencia de energía en forma calorífica entre el sistema y su entorno u otro sistema, 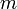 es la masa del sistema (se usa una n cuando se trata del calor específico molar) y
es la masa del sistema (se usa una n cuando se trata del calor específico molar) y 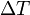 es el incremento de temperatura que experimenta el sistema. El calor específico (
es el incremento de temperatura que experimenta el sistema. El calor específico ( ) correspondiente a una temperatura dada
) correspondiente a una temperatura dada 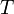 se define como:
se define como: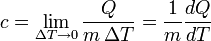
El calor específico (
 ) es una función de la temperatura del sistema; esto es,
) es una función de la temperatura del sistema; esto es, 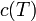 . Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función
. Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función 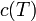 , la cantidad de calor asociada con un cambio de temperatura del sistema desde la tempertaura inicial Ti a la final Tf se calcula mediante la integral siguiente:
, la cantidad de calor asociada con un cambio de temperatura del sistema desde la tempertaura inicial Ti a la final Tf se calcula mediante la integral siguiente: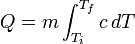
Cantidad de sustancia
Cuando se mide el calor específico en ciencia e ingeniería, la cantidad de sustancia es a menudo de masa: ya sea en gramos o en kilogramos, ambos del SI. Especialmente en química, sin embargo, conviene que la unidad de la cantidad de sustancia sea el mol al medir el calor específico, el cual es un cierto número de moléculas o átomos de la sustancia.[7] Cuando la unidad de la cantidad de sustancia es el mol, el término calor específico molar se puede usar para referirse de manera explícita a la medida; o bien usar el término calor específico másico, para indicar que se usa una unidad de masa.
Conceptos relacionados
Hay dos condiciones notablemente distintas bajo las que se mide el calor específico y éstas se denotan con sufijos en la letra c. El calor específico de los gases normalmente se mide bajo condiciones de presión constante (Símbolo: cp). Las mediciones a presión constante producen valores mayores que aquellas que se realizan a volumen constante (cv), debido a que en el primer caso se realiza un trabajo de expansión.
El cociente entre los calores específicos a presión constante y a volumen constante para una misma sustancia o sistema termodinámico se denomina coeficiente adiabático y se le designa mediante la letra griega
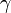 (gamma).[8] Este parámetro aparece en fórmulas físicas como por ejemplo la de la velocidad del sonido en un gas ideal.
(gamma).[8] Este parámetro aparece en fórmulas físicas como por ejemplo la de la velocidad del sonido en un gas ideal.El calor específico de las sustancias distintas de los gases monoatómicos no está dado por constantes fijas y puede variar un poco dependiendo de la temperatura [2]. Por lo tanto, debe especificarse con precisión la temperatura a la cual se hace la medición. Así, por ejemplo, el calor específico del agua exhibe un valor mínimo de 0,99795 cal/(g·K) para la temperatura de 34,5 °C, en tanto que vale 1,00738 cal/(g·K) a 0 °C. Por consiguiente, el calor específico del agua varía menos del 1% respecto de su valor de 1 cal/(g·K) a 15 °C, por lo que a menudo se le considera como constante.
La presión a la que se mide el calor específico es especialmente importante para gases y líquidos.
Unidades
Unidades de calor
La unidad de medida del calor en el Sistema Internacional es el joule (J). La caloría (cal) también se usa frecuentemente en las aplicaciones científicas y tecnológicas. La caloría se define como la cantidad de calor necesario para aumentar en 1 °C la temperatura de un gramo de agua destilada, en el intervalo de 14,5 °C a 15,5 °C.[9] es decir tiene una definición basada en el calor específico.
Unidades de calor específico
En el Sistema Internacional de Unidades, el calor específico se expresa en julios por kilogramo y por kelvin (J·kg-1·K-1); otra unidad, no perteneciente al SI, es la caloria por gramo y por kelvin (cal·g-1·K-1). Así, el calor específico del agua es aproximadamente 1 cal/(g·K) en un amplio intervalo de temperaturas, a la presión atmosférica; exactamente 1 cal·g-1·K-1 en el intervalo de 14,5 °C a 15,5 °C.
En los Estados Unidos, y en otros pocos países donde se sigue utilizando el Sistema Anglosajón de Unidades, el calor específico se suele medir en BTU (unidad de calor) por libra (unidad de masa) y grado Fahrenheit (unidad de temperatura).
La BTU se define como la cantidad de calor que se requiere para elevar un grado Fahrenheit la temperatura de una libra de agua en condiciones atmosféricas normales.[10]
Factores que afectan el calor específico
 Las moléculas tienen una estructura interna porque están compuestas de átomos que tienen diferentes formas de moverse en las moléculas. La energía cinética almacenada en estos grados de libertad internos no contribuye a la temperatura de la sustancia sino a su calor específico.
Las moléculas tienen una estructura interna porque están compuestas de átomos que tienen diferentes formas de moverse en las moléculas. La energía cinética almacenada en estos grados de libertad internos no contribuye a la temperatura de la sustancia sino a su calor específico.
Grados de libertad
El comportamiento termodinámico de las moléculas de los gases monoatómicos, como el helio y de los gases biatómicos, el hidrógeno es muy diferente. En los gases monoatómicos, la energía interna corresponde únicamente a movimientos de traslación. Los movimientos traslacionales son movimientos de cuerpo completo en un espacio tridimensional en el que las partículas se mueven e intercambian energía en colisiones en forma similar a como lo harían pelotas de goma encerradas en un recipiente que se agitaran con fuerza. (vea la animación aquí). Estos movimientos simples en los ejes dimensionales X, Y, y Z implican que los gases monoatómicos sólo tienen tres grados de libertad traslacionales.
Las moléculas con mayor atomicidad, en cambio tienen varios grados de libertad internos, rotacionales y vibracionales, adicionales ya que son objetos complejos. SE comportan como una población de átomos que pueden moverse dentro de una molécula de distintas formas (ver la animación a la derecha). La energía interna se almacena en estos movimientos internos. Por ejemplo, el Nitrógeno, que es una molécula diatómica, tiene cinco grados de libertad disponibles: los tres traslacionales más dos rotacionales de libertad interna. Cabe destacar que la capacidad calorífica molar a volumen constante de los gases monoatómicos es
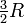 , siendo R la Constante Universal de los gases ideales, mientras que para el Nitrógeno (biatómico) vale
, siendo R la Constante Universal de los gases ideales, mientras que para el Nitrógeno (biatómico) vale 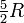 , lo cual muestra claramente la relación entre los grados de libertad y el calor específico.
, lo cual muestra claramente la relación entre los grados de libertad y el calor específico.Masa molar
Una de las razones por las que el calor específico adopta diferentes valores para diferentes sustancias es la diferencia en masas molares, que es la masa de un mol de cualquier elemento, la cual es directamente proporcional a la masa molecular del elemento, suma de los valores de las masas atómicas de la molécula en cuestión. La energía calorífica se almacena gracias a la existencia de átomos o moléculas vibrando. Si una sustancia tiene una masa molar más ligera, entonces cada gramo de ella tiene más átomos o moléculas disponible para almacenar energía. Es por esto que el hidrógeno, la sustancia con la menor masa molar, tiene un calor específico tan elevado; porque un gramo de esta sustancia contiene una cantidad tan grande de moléculas.
Una consecuencia de este fenómeno es que, cuando se mide el calor específico en términos molares la diferencia entre sustancias se hace menos pronunciada, y el calor específico del hidrógeno deja de ser atípico. En forma correspondiente, las sustancias moleculares (que también absorben calor en sus grados internos de libertad), pueden almacenar grandes cantidades de energía por mol si se trata de moléculas grandes y complejas, y en consecuencia su calor específico medido en términos másicos es menos notable.
Ya que la densidad neta de un elemento químico está fuertemente relacionada con su masa molar, existe en términos generales, una fuerte correlación inversa entre la densidad del sólido y su cp (calor específico a presión constante medido en términos másicos). Grandes lingotes de sólidos de baja densidad tienden a absorber más calor que un lingote pequeño de un sólido de la misma masa pero de mayor densidad ya que el primero por lo general contiene más átomos. En consecuencia, en términos generales, hay una correlación cercana entre el volumen de un elemento sólido y su capacidad calorífica total. Hay sin embargo, muchas desviaciones de esta correlación general.
Enlaces puente de hidrógeno
Las moléculas que contienen enlaces polares de hidrógeno tienen la capacidad de almacenar energía calorífica en éstos enlaces, conocidos como puentes de hidrógeno.
Impurezas
En el caso de las aleaciones, hay ciertas condiciones en las cuales pequeñas impurezas pueden alterar en gran medida el calor específico medido. Las aleaciones pueden mostrar una marcada diferencia en su comportamiento incluso si la impureza en cuestión es uno de los elementos que forman la aleación; por ejemplo, las impurezas en aleaciones semiconductoras ferromagnéticas pueden llevar a mediciones muy diferentes, tal como predijeron por primera vez White y Hogan.[11]
Tabla de calores específicos
Sustancia Fase cp
(másico)
kJ·kg−1·K−1cp
(molar)
J·mol−1·K−1cv
(molar)
J·mol−1·K−1Capacidad
calorífica volumétrica
J cm-3 K-1Gas monoatómico (Ideal) gas 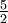 R = 20.8
R = 20.8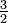 R =12.5
R =12.5Helio gas 5,1932 20,8 12,5 Argón gas 0,5203 20,8 12,5 Gas diatómico (Ideal) gas 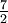 R = 29.1
R = 29.1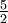 R = 20.8
R = 20.8Hidrógeno gas 14,30 28,82 20.4 Nitrógeno gas 1,040 29,12 20,8 Oxígeno gas 0,918 29,4 21.1 Aire (en condiciones típicas de habitación[3]) gas 1,012 29,19 Aluminio sólido 0,897 24,2 2,422 Amoníaco líquido 4,700 80,08 3,263 Antimonio sólido 0,207 25,2 1,386 Arsénico sólido 0,328 24,6 1,878 Berilio sólido 1,82 16,4 3,367 Cobre sólido 0,385 24,47 3,45 Diamante sólido 0,5091 6,115 1,782 Etanol líquido 2,44 112 1,925 Gasolina líquido 2,22 228 Oro sólido 0,1291 25,42 2,492 Grafito sólido 0,710 8,53 1,534 Hierro sólido 0,450 25,1 3,537 Plomo sólido 0,127 26,4 1,44 Litio sólido 3,58 24,8 1,912 Magnesio sólido 1,02 24,9 1,773 Mercurio líquido 0,1395 27,98 1,888 Neón gas 1,0301 20,7862 12,4717 cera de parafina sólido 2,5 900 2,325 Sílice (fundido) sólido 0,703 42,2 1,547 Uranio sólido 0,116 27,7 2,216 Agua gas (100 °C) 2,080 37,47 28,03 Agua líquido (25 °C) 4,1813 75,327 74,53 4,184 Agua sólido (0 °C) 2,114 38,09 1,938 Todas las medidas son a 25 °C a menos que se indique lo contrario,
Los mínimos y máximos notables se muestran en negrita.↑ Divida el calor específico másico del Magnesio entre 8 y comprobará que es muy cercano a ocho veces el del Plomo.
↑ Suponiendo una altitud de 194 metros (el promedio de la población mundial), una temperatura de 23 °C, un 40,85% de humedad y 760 mmHg de presión.
↑ Puede notar que el calor específico (molar) de los gases monoatómicos se comporta de acuerdo a ciertas constantes, mientras que los valores predichos para otros gases no se ajustan con la misma precisión.
Materiales de construcción
Estos datos son de utilidad al calcular los efectos del calor sobre los materiales:
Sustancia Estado de agregación cp
J g−1 K−1Asfalto sólido 0,92 Ladrillo sólido 0,84 Hormigón sólido 0,88 Vidrio, sílice sólido 0,84 Vidrio, crown sólido 0,67 Vidrio, flint sólido 0,503 Vidrio, pyrex sólido 0,753 Granito sólido 0,790 Aljez sólido 1,09 Mármol, mica sólido 0,880 Arena sólido 0,835 Suelo sólido 0,80 Madera sólido 0,48 Véase también
Referencias
- ↑ Resnik, Halliday & Krane (2002). Física Volumen 1. Cecsa. ISBN 970-24-0257-3.
- ↑ Enciclopedia Encarta. «calor específico». Consultado el 12/02/2008.
- ↑ name="Krane2002"
- ↑ Luis Chica (2004). «Calorimetría». Consultado el 17/02/2008.
- ↑ Laider, Keith, J. (1993). Oxford University Press (ed.). The World of Physical Chemistry (en inglés). ISBN 0-19-855919-4.
- ↑ Serway Jewet (2003). Física 1. Thomson. ISBN 970-686-339-7.
- ↑ Prof. Castroja y Prof. Pereira. «Termodinámica». Consultado el 17/02/2008.
- ↑ «Primer principio de la termodinámica». Consultado el 17/02/2008.
- ↑ «Caloría». Consultado el 17/02/2008.
- ↑ «Glasario de Abreviaciones». Consultado el 14/02/2008.
- ↑ C. Michael Hogan (1969). «Density of States of an Insulating Ferromagnetic Alloy Phys. Rev. 188, 870 - 874, Issue 2 – December 1969» (en inglés). Consultado el 14/01/2008.
Bibliografía
- Resnik, Robert (2002). «Primera Ley de la Termodinámica», Física 1. México D.F.: CECSA. ISBN 970-24-0257-3.
- Raymond A., Serway; Jewet, John W. (2003). «Calor específico», Física 1. México D.F.: Thomson. ISBN 970-686-339-7.
Enlaces externos
- Todo o parte de este artículo fue creado a partir de la traducción del artículo Specific heat capacity de la Wikipedia en inglés, bajo licencia Creative Commons Compartir Igual 3.0. y GFDL.
Categorías: Calorimetría | Climatización
Wikimedia foundation. 2010.
