- Conformación del ciclohexano
-
La conformación del ciclohexano es un tópico muy estudiado en química orgánica debido a las complejas interrelaciones entre los diferentes confórmeros del ciclohexano y sus derivados. Confórmeros diferentes pueden tener propiedades diferentes, incluyendo estabilidad y reactividad química.
Contenido
Fondo histórico
La primera sugerencia de que el ciclohexano podría no ser una molécula plana es de hace mucho tiempo. En 1890, Hermann Sachse, un asistente de 28 años en Berlín, publicó instrucciones para doblar una hoja de papel para representar dos formas de ciclohexano que llamó simétrica y no simétrica (lo que ahora llamaríamos silla y bote). Entendió claramente que estas formas tienen dos posiciones para los hidrógenos (nuevamente, para usar terminología moderna, axial y ecuatorial), que dos sillas probablemente se interconverterían entre sí, e incluso cómo ciertos sustituyentes favorecerían las formas de silla. Debido a que expresó todo en lenguaje matemático, pocos químicos de la época entendieron sus argumentos. Hizo algunos intentos en publicar sus ideas, pero ninguno tuvo éxito en capturar la imaginación de los químicos. Su muerte en 1893, a la edad de 31 años, significó que sus ideas se hundieran en la oscuridad. Fue recién en 1918 cuando Ernst Mohr, usando la nueva técnica de la cristalografía de rayos X, fue capaz de determinar la estructura del diamante, reconociéndose ahí el modelo de silla de Sachse.[1] [2] [3]
Conformación de silla
Debido a la inherente tendencia de los orbitales híbridos sp3 de los átomos de carbono tetravalentes de formar ángulos de enlace de 109.5 °, el ciclohexano no forma un arreglo hexagonal plano con ángulos interiores de 120 °. La conformación de silla es un término usado para la conformación química más estable de un anillo de seis átomos de carbono unidos por enlace simple, como el ciclohexano. Derek Barton y Odd Hassel compartieron el Premio Nóbel por su trabajo en las conformaciones del ciclohexano y otras moléculas.
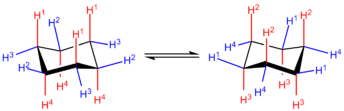
En la conformación de silla de mínima energía, 6 de los 12 hidrógenoes están en posiciones axiales (coloreadas de rojo)—sus enlaces C-H son paralelos unos a otros y parecen salir arriba y abajo de la estructura del anillo, los otros 6 están en posiciones ecuatoriales (coloreadas de azul)-están dispuestos alrededor del perímetro del anillo. Observe que, además, un hidrógeno en cada posición está "arriba" respecto al otro que está "abajo" en dicha posición.
Al recorrer alrededor del anillo, puede verse que las posiciones axiales hacia arriba (H1 en la estructura a la mano izquierda) alternan con las posiciones ecuatoriales hacia arriba (H2). Además, las posiciones axiales alternan lados alrededor del anillo (H1 axial-arriba vs H4 axial-abajo) y del mismo modo las posiciones ecuatoriales (H2 ecuatorial-arriba vs H3 ecuatorial-abajo). Para dos sustituyentes unidos a carbonos adyacentes en el anillo como en el inversión del anillo o inversión de la silla, la conformación del anillo cambia, conduciendo a los hidrógenos axiales a ser ecuatoriales, y los hidrógenos ecuatoriales a ser axiales. Sin embargo, la dirección relativa de los hidrógenos al anillo sigue siendo la misma: un hidrógeno axial "arriba", cuando se invierte, permanece como un hidrógeno ecuatorial "arriba". Las dos conformaciones de silla pueden diferir en estabilidad, dependiendo de la identidad de los grupos funcionales. Generalmente, los sustituyentes son más estables cuando están en posiciones ecuatoriales, pues en este caso no hay interacción diaxial 1,3 entre el grupo sustituyente axial y cualquier otro grupo axial en el anillo. Por ejemplo, si hay un grupo metilo en el carbono 1 en una posición axial, interactuará con los hidrógenos axiales en el carbono 3 y carbono 5. Sin embargo, cuando hay heteroátomos electronegativos involucrados, puede observarse lo contrario; esto es denominado el efecto anomérico. El ciclohexano se encontrará en la conformación de silla en un 99,99% a 25 °C (esto es, 99.99% de todas las moléculas en una muestra de solución estarán en la conformación de silla).
La preferencia de un sustituyente hacia la conformación ecuatorial está medida en términos de su valor A, que es la diferencia en la energía libre de Gibbs entre los confórmeros ecuatorial y axial. Un valor positivo de A indica preferencia hacia la posición ecuatorial. La magnitud de los valores de A varían de casi cero para sustituyentes muy pequeños como el deuterio, hasta aproximadamente 5 kcal/mol para sustituyentes muy voluminosos como el grupo editar] Conformación de bote
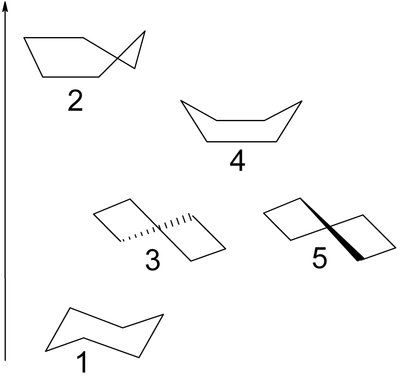
Además de la conformación de silla (1) con simetría D3d, el ciclohexano puede existir en los confórmeros de media silla o envoltura (2), torcida o bote torcido (3,5) con simetría D2 y bote (4). Sólo la forma torcida es aislable puesto que - como la forma de silla - representa un mínimo de energía. La conformación de bote no sufre de tensión angular, pero tiene una energía más alta que la forma de silla debido a la tensión estérica resultante de los dos átomos de hidrógeno 1,4 en la que es llamada interacción de asta de bandera. La tensión torsional en la conformación de bote tiene un valor máximo porque dos de los enlaces de carbono están eclipsados. Comparado con la conformación alternada de los enlaces en la forma sill, y la ausencia completa de tensión torsional, o la conformación de bote torcido con 4 de 6 enlaces parcialmente alternados. En la conformación de media silla, 4 átomos de carbono están ubicados en un plano, en el que dos enlaces están completamente eclipsados.
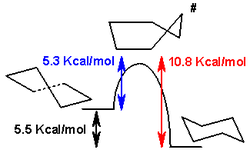
Las formas de bote y envoltura son estados de transición entre las formas torcida y silla, y son imposibles de ser aisladas. La conformación de bote torido es 5,5 kcal/mol (23 kJ/mol) menos estable que la conformación de silla. Las energía de los dos estados de transición son 6,6 kcal/mol (28 kJ/mol) (bote) y 10,8 kcal/mol (45 kJ/mol) (media silla) mayores que la de silla.[4] El proceso de inversión de anillo puede ser descrito ahora con mayor precisión como si tomara lugar a través de una conformación de bote torcido, y dos estados de transición de media silla.
La diferencia en energía entre la conformación de silla y de bote torcido puede ser medida indirectamente tomando la diferencia en energía de activación para la conversión de la conformación de silla a la de bote torcido, y de la isomerización reversa. La concentración de conformación de bote torcido a temperatura ambiente es muy baja (menor al 0,1%) pero a 1073 K, esta concentración puede alcanzar el 30%. La reacción inversa es medida por espectroscopia infrarroja después de enfriar rápidamente el ciclohexano desde 1073 K a 40 K, congelando en la gran concentración de conformación de bote torcido.
El [6.6]Quiralano[5] [6] es una molécula con grupo de puntos T, compuesta completamente de ciclohexanos idénticos en bote fundidos. El twistano es otro compuesto con una conformación forzada de bote torcido.
Derivados de ciclohexano
Los sustituyentes encontrados en el ciclohexano adoptan metileno reemplazados por un grupo azufre, eliminando entonces las desfavorables interacciones diaxiales 1,3. En el análogo tetrametil 3,3,6,6-tetrametil-1,2,4-5-tetratiano, la conformación de bote torcido es la que domina realmente. También en la ciclohexano-1,4-diona con la interacción estérica de hidrógeno 1,4 eliminada, la conformación más estable es realmente la de bote torcido.
El cis-1,4-di-tert-butilciclohexano tiene un grupo axial espectroscopia RMN.
Efecto de sustituyentes polares
- El cis-ciclohexano-1,3-diol prefiere la conformación diaxial por formación de un enlace de hidrógeno intramolecular.
- El 2,5-di-tert-butil-1,4-ciclohexanodiol se presenta en conformación de bote o bote torcido debido a que también forma un enlace de hidrógeno intramolecular.
- La 2-bromociclohexanona prefiere un Br axial, porque se minimiza la repulsión dipolar.
- La 2-bromo-4,4-dimetilciclohexanona prefiere un Br ecuatorial (con interacción diaxial 1,3) más que una repulsión dipolar:
- El trans-1,2-dibromociclohexano se presenta en forma axial en solventes no polares, puesto que los dipolos se cancelan, mientras que en posición ecuatorial en solventes polares, puesto que los dipolos se refuerzan.
Referencias
- ↑ H. Sachse, Chem. Ber, 1890, 23, 1363; Z. Physik. Chem, 1892, 10, 203; Z. Physik. Chem., 1893, 11, 185-219.
- ↑ E. Mohr, J. Prakt. Chem., 1918, 98, 315 and Chem. Ber., 1922, 55, 230.
- ↑ Esta historia se resume brevemente aquí (en Inglés).
- ↑ Conformational Study of cis-1,4-Di-tert-butylcyclohexane by Dynamic NMR Spectroscopy and Computational Methods. Observation of Chair and Twist-Boat Conformations Gill, G.; Pawar, D. M.; Noe, E. A J. Org. Chem. (Article); 2005; 70(26); 10726-10731. DOI: 10.1021/jo051654z Abstract
- ↑ http://www.mazepath.com/uncleal/chiral2.gif Chiralane
- ↑ http://www.mazepath.com/uncleal/chiral3.gif
Enlaces externos
- [http://wetche.cmbi.ru.nl//organic/cyclohexane/jm/chxjmol.html Animation of cyclohexane, applets de Java mostrando distintas conformaciones, por la Universidad de Nijmegen
Wikimedia foundation. 2010.