- Corrosión
-
La corrosión se define como el deterioro de un material a consecuencia de un ataque electroquímico por su entorno. De manera más general, puede entenderse como la tendencia general que tienen los materiales a buscar su forma más estable o de menor energía interna. Siempre que la corrosión esté originada por una reacción electroquímica (oxidación), la velocidad a la que tiene lugar dependerá en alguna medida de la temperatura, de la salinidad del fluido en contacto con el metal y de las propiedades de los metales en cuestión. Otros materiales no metálicos también sufren corrosión mediante otros mecanismos.
La corrosión puede ser mediante una reacción química (oxidorreducción) en la que intervienen tres factores:
- La pieza manufacturada
- El ambiente
- El agua
O por medio de una reacción electroquímica.
Los factores más conocidos son las alteraciones químicas de los metales a causa del aire, como la herrumbre del hierro y el acero o la formación de pátina verde en el cobre y sus aleaciones (bronce, latón).
Sin embargo, la corrosión es un fenómeno mucho más amplio que afecta a todos los materiales (metales, cerámicas, polímeros, etc.) y todos los ambientes (medios acuosos, atmósfera, alta temperatura, etc.).
Es un problema industrial importante, pues puede causar accidentes (ruptura de una pieza) y, además, representa un costo importante, ya que se calcula que cada pocos segundos se disuelven 5 toneladas de acero en el mundo, procedentes de unos cuantos nanómetros o picómetros, invisibles en cada pieza pero que, multiplicados por la cantidad de acero que existe en el mundo, constituyen una cantidad importante.
La corrosión es un campo de las ciencias de materiales que invoca a la vez nociones de química y de física (físico-química).
Por ejemplo un metal muestra una tendencia inherente a reaccionar con el medio ambiente (atmósfera, agua, suelo, etc.) retornando a la forma combinada. El proceso de corrosión es natural y espontáneo.
Definiciones básicas
Lo que provoca la corrosión es un flujo eléctrico masivo generado por las diferencias químicas entre las piezas implicadas.La corrosión es un fenómeno electroquímico. Una corriente de electrones se establece cuando existe una diferencia de potenciales entre un punto y otro. Cuando desde una especie química cede y migran electrones hacia otra especie, se dice que la especie que los emite se comporta como un ánodo y se verifica la oxidación, y aquella que los recibe se comporta como un cátodo y en ella se verifica la reducción.
Para que esto ocurra entre las especies, debe existir un diferencial electroquímico. Si separamos una especie y su semireacción, se le denominará semipar electroquímico; si juntamos ambos semipares, se formará un par electroquímico. Cada semipar está asociado a un potencial de reducción (antiguamente se manejaba el concepto de potencial de oxidación). Aquel metal o especie química que exhiba un potencial de reducción más positivo procederá como una reducción y, viceversa, aquél que exhiba un potencial de reducción más negativo procederá como una oxidación.
Para que haya corrosión electroquímica, además del ánodo y el cátodo debe haber un electrólito (por esta razón, también se suele llamar corrosión húmeda, aunque el electrólito también puede ser sólido). La transmisión de cargas eléctricas es por electrones del ánodo al cátodo (por medio del metal) y por iones en el electrólito.
Este par de metales constituye la llamada pila galvánica, en donde la especie que se oxida (ánodo) cede sus electrones y la especie que se reduce (cátodo) acepta electrones. Al formarse la pila galvánica, el cátodo se polariza negativamente, mientras el ánodo se polariza positivamente.
En un medio acuoso, la oxidación del medio se verifica mediante un electrodo especial, llamado electrodo ORP, que mide en milivoltios la conductancia del medio.
La corrosión metálica química es por ataque directo del medio agresivo al metal, oxidándolo, y el intercambio de electrones se produce sin necesidad de la formación del par galvánico.
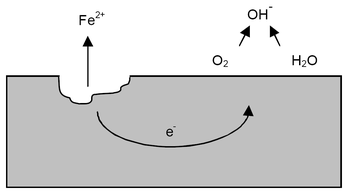
Esquema de oxidación del hierro, ejemplo de corrosión del tipo polarizada.
La manera de corrosión de los metales es un fenómeno natural que ocurre debido a la inestabilidad termodinámica de la mayoría de los metales. En efecto, salvo raras excepciones (el oro, el hierro de origen meteorítico) los metales están presentes en la Tierra en forma de óxido, en los minerales (como la bauxita si es aluminio, la hematita si es hierro...). Desde la prehistoria, toda la metalurgia ha consistido en reducir los óxidos en bajos hornos, luego en altos hornos, para fabricar el metal. La corrosión, de hecho, es el regreso del metal a su estado natural, el óxido.
A menudo se habla del acero inoxidable:
- este tipo de acero contiene elementos de aleación (cromo ) en 11% como mínimo lo cual le permite ser inoxidable al estar expuesto al oxigeno , además de ser un estabilizador de la ferita.
- el cromo hace que se contraiga la región de la austenita y en su lugar la región de la ferrita disminuye su tamaño.
Existen múltiples variedades de aceros llamados "inoxidables", que llevan nombres como "304", "304L", "316N", etc., correspondientes a distintas composiciones y tratamientos. Cada acero corresponde a ciertos tipos de ambiente; Acero inoxidable ferrítico, martensítico, austeníticos, endurecidos por precipitación (PH) y dúplex.
Protección contra la corrosión
Diseño
El diseño de las estructuras del metal, estas pueden retrasar o incluso eliminar la corrosión.
Recubrimientos
Estos son usados para aislar las regiones anódicas y catódicas e impiden la difusión del oxigeno o del vapor de agua los cuales son una gran fuente que inicia la corrosión o la oxidación.
Elección del material
La primera idea es escoger todo un material que no se corroa en el ambiente considerado. Se pueden utilizar aceros inoxidables, aluminios, cerámicas, polímeros (plásticos), FRP, etc. La elección también debe tomar en cuenta las restricciones de la aplicación (masa de la pieza, resistencia a la deformación, al calor, capacidad de conducir la electricidad, etc.).
Cabe recordar que no existen materiales absolutamente inoxidables; hasta el aluminio se puede corroer.
En la concepción, hay que evitar las zonas de confinamiento, los contactos entre materiales diferentes y las heterogeneidades en general.
Hay que prever también la importancia de la corrosión y el tiempo en el que habrá que cambiar la pieza (mantenimiento preventivo).
Dominio del ambiente
Cuando se trabaja en ambiente cerrado (por ejemplo, un circuito cerrado de agua), se pueden dominar los parámetros que influyen en la corrosión; composición química (particularmente la acidez), temperatura, presión... Se puede agregar productos llamados "inhibidores de corrosión". Un inhibidor de corrosión es una sustancia que, añadida a un determinado medio, reduce de manera significativa la velocidad de corrosión. Las sustancias utilizadas dependen tanto del metal a proteger como del medio, y un inhibidor que funciona bien en un determinado sistema puede incluso acelerar la corrosión en otro sistema.
Sin embargo, este tipo de solución es inaplicable cuando se trabaja en medio abierto (atmósfera, mar, cuenca en contacto con el medio natural, circuito abierto, etc.)
Inhibidores de la corrosión
Es el traslado de los productos químico que se agrega a una solución electrolítica hacia la superficie del ánodo o del cátodo lo cual produce polarización.
Los inhibidores de corrosión, son productos que actúan ya sea formando películas sobre la superficie metálica, tales como los molibdatos, fosfatos o etanolaminas, o bien entregando sus electrones al medio. Por lo general los inhibidores de este tipo son azoles modificados que actúan sinérgicamente con otros inhibidores tales como nitritos, fosfatos y silicatos. La química de los inhibidores no está del todo desarrollada aún. Su uso es en el campo de los sistemas de enfriamiento o disipadores de calor tales como los radiadores, torres de enfriamiento, calderas y "chillers". El uso de las etanolaminas es típico en los algunos combustibles para proteger los sistemas de contención (como tuberías y tanques).Y además la inhalación es mala para los pulmones Se han realizado muchos trabajos acerca de inhibidores de corrosión como alternativas viables para reducir la velocidad de la corrosión en la industria. Extensos estudios sobre IC y sobre factores que gobiernan su eficiencia se han realizado durante los últimos 20 años. Los cuales van desde los más simples que fueron a prueba y error y hasta los más modernos los cuales proponen la selección del inhibidor por medio de cálculos teóricos.
Tipos de corrosión
 Corrosión en un ancla.
Corrosión en un ancla.
Existen muchos mecanismos por los cuales se verifica la corrosión, que tal como se ha explicado anteriormente es fundamentalmente un proceso electroquímico.
Corrosión Química
En la corrosión química un material se disuelve en un medio corrosivo líquido y este se seguirá disolviendo hasta que se consuma totalmente o se sature el líquido.
Las aleaciones base cobre desarrollan una barniz verde a causa de la formación de carbonato e hidróxidos de cobre, esta es la razón por la cual la Estatua de la Libertad se ve con ese color verduzco.
Ataque por Metal Líquido
Los metales líquidos atacan a los sólidos en sus puntos más altos de energía como los límites de granos lo cual a la larga generará grietas. jo
Lixiviación selectiva
Consiste en separar sólidos de una aleación. La corrosión grafítica del hierro fundido gris ocurre cuando el hierro se diluye selectivamente en agua o la tierra y desprende cascarillas de grafito y un producto de la corrosión, lo cual causa fugas o fallas en la tubería.
Disolución y oxidación de los materiales cerámico
Pueden ser disueltos los materiales cerámicos refractarios que se utilizan para contener el metal fundido durante la fusión y el refinado por las escorias provocadas sobre la superficie del metal.
Ataque Químico a los Polímeros
Los plásticos son considerados resistentes a la corrosión, por ejemplo el Teflón y el Vitón son algunos de los materiales más resistentes, estos resisten muchos ácidos , bases y líquidos orgánicos pero existen algunos solventes agresivos a los termoplásticos , es decir las moléculas del solvente más pequeñas separan las cadenas de los plásticos provocando hinchazón que ocasiona grietas.
Corrosión electroquímica o polarizada
La corrosión electroquímica se establece cuando en una misma superficie metálica ocurre una diferencia de potencial en zonas muy próximas entre sí en donde se establece una migración electrónica desde aquella en que se verifica el potencial de oxidación más elevado, llamado área anódica hacia aquella donde se verifica el potencial de oxidación más bajo, llamado área catódica.
El conjunto de las dos semi reacciones constituye una célula de corrosión electroquímica.
La corrosión electroquímica es debida a la circulación de electrones entre zonas de diferente potencial, en contacto con el medio conductor. Esta diferencia de potencial puede darse entre dos puntos de un mismo material en cuyo caso la diferencia de potencial no acostumbra a ser elevada o entre diferentes metales dando lugar a una pila galvánica en la que la corriente de corrosión es importante.
Es característica de este tipo de corrosión la localización de la zona de corrosión; esto puede dar lugar a consecuencias catastróficas a pesar de que la pérdida de material puede no ser muy importante.
En una pila de corrosión la pérdida de material corresponderá a la zona o metal más electronegativo que se denominará zona anódica y será donde se concentra la salida de la corriente al medio. La zona de entrada de la corriente, denominada zona catódica no sufrirá ningún deterioro y corresponde al potencial más electropositivo.
Tipos de corrosión electroquímica
Celdas de composición
Se presentan cuando dos metales o aleaciones, tal es el caso de cobre y hierro forma una celda electrolítica. Con el efecto de polarización de los elementos aleados y las concentraciones del electrolito las series fem quizá no nos digan que región se corroerá y cual quedara protegida.
Celdas de esfuerzo
La corrosión por esfuerzo se presenta por acción galvaniza pero puede suceder por la filtración de impurezas en el extremo de una grieta existente. La falla se presenta como resultado de la corrosión y de un esfuerzo aplicado, a mayores esfuerzos el tiempo necesario para la falla se reduce.
Corrosión por oxígeno
Este tipo de corrosión ocurre generalmente en superficies expuestas al oxígeno diatómico disuelto en agua o al aire, se ve favorecido por altas temperaturas y presión elevada ( ejemplo: calderas de vapor). La corrosión en las máquinas térmicas (calderas de vapor) representa una constante pérdida de rendimiento y vida útil de la instalación.
Corrosión microbiológica
Es uno de los tipos de corrosión electroquímica. Algunos microorganismos son capaces de causar corrosión en las superficies metálicas sumergidas. Se han identificado algunas especies hidrógeno-dependientes que usan el hidrógeno disuelto del agua en sus procesos metabólicos provocando una diferencia de potencial del medio circundante. Su acción está asociada al pitting (picado) del oxígeno o la presencia de ácido sulfhídrico en el medio. En este caso se clasifican las ferrobacterias.
Corrosión por presiones parciales de oxígeno
El oxígeno presente en una tubería por ejemplo, está expuesto a diferentes presiones parciales del mismo. Es decir una superficie es más aireada que otra próxima a ella y se forma una pila. El área sujeta a menor aireación (menor presión parcial) actúa como ánodo y la que tiene mayor presencia de oxígeno (mayor presión) actúa como un cátodo y se establece la migración de electrones, formándose óxido en una y reduciéndose en la otra parte de la pila. Este tipo de corrosión es común en superficies muy irregulares donde se producen obturaciones de oxígeno.
Corrosión galvánica
Es la más común de todas y se establece cuando dos metales distintos entre sí actúan como ánodo uno de ellos y el otro como cátodo. Aquel que tenga el potencial de reducción más negativo procederá como una oxidación y viceversa aquel metal o especie química que exhiba un potencial de reducción más positivo procederá como una reducción. Este par de metales constituye la llamada pila galvánica. En donde la especie que se oxida (ánodo) cede sus electrones y la especie que se reduce (cátodo) acepta los electrones.
Corrosión por actividad salina diferenciada
Este tipo de corrosión se verifica principalmente en calderas de vapor, en donde la superficie metálica expuesta a diferentes concentraciones salinas forman a ratos una pila galvánica en donde la superficie expuesta a la menor concentración salina se comporta como un ánodo.
Corrosión por heterogeneidad del material
Se produce en aleaciones metálicas, por imperfecciones en la aleación.
Corrosión por aireación superficial
También llamado Efecto Evans. Se produce en superficies planas, en sitios húmedos y con suciedad. El depósito de suciedad provoca en presencia de humedad la existencia de un entorno más electronegativamente cargado.
Métodos preventivos de protección
Antes de dar una protección hay que preparar la superficie del metal, limpiándola de materiales ajenos (limpieza y desengrasado)
RECUBRIMIENTO EN FORMA DE LÍQUIDO (aplicado como una pintura)
Variables que determinan la capacidad protectora de un sistema de pinturas aplicado sobre un sustrato metálico.
- Tipo de sustrato.- Para poder identificar qué métodos de pintado son los que se pueden utilizar.
- Sistema de pintado.- Una vez conocido que tipo de sustrato se saber si puede tener una adhesión entre los materiales en cuestión
- Preparación superficial.- Al conocer el sistema de pintado se puede saber qué es lo necesario para poder generar la mejor adhesión
- Pre-tratamiento.- El pre-tratamiento es similar a la preparación superficial, considerando el pre-tratamiento de la superficie, pero se puede dar el caso de un pre-tratamiento en la pintura, que podría ser tal vez lo llamado preparación de la pintura.
- Espesor total y por capa.- Dependiendo del tipo de método escogido se va a tener los diferentes espesores de la pintura
- Adhesión metal/pintura.- Es la más importante debido a que si no se tiene una buena adhesión entre los dos materiales, no tiene sentido seguir estudiando los demás casos si por ejemplo no se va a poder pintar. Y cuanto más se prolonga la adhesión menor es la posibilidad de que se inicie el proceso de corrosión.
- Composición de las pinturas.- Puede considerarse posteriormente este punto ya que dependiendo de la composición de las pinturas se va a poner los diferentes tipos de ligantes, pigmentos y disolventes
- Compatibilidad entre capas.- Esto es importante ya que de esto va a depender el método de aplicación, y conociendo la composición de las pinturas
- Método de aplicación.- Si se sabe qué tipo de compatibilidad se tiene, entonces se puede escoger el método que se acople a dicha compatibilidad.
CAPA NO METÁLICA
- barnices, esmaltes, lacas... que deben formar una capa impermeable, contínua y adherente de 120 micras de espesor como mínimo.
CAPA METÁLICA
- Se puede aplicar en forma de líquido (a base de gotas) y debe tener carga electroquímica menor que el material que protege.
Véase también
Casos especiales de corrosión:
- Corrosión galvánica
- Corrosión a alta temperatura
- Corrosión acuosa
- Corrosión atmosférica
- Corrosión bajo tensión
- Corrosión forzada
- Corrosión por cavitación
- Corrosión por Erosión
- Corrosión por fatiga
- Corrosión por fricción
- Descarburización del acero
- Descincación
- Fragilidad por hidrógeno
- Galvanizado
- Pintura anticorrosiva
Bibliografía
- [ASM96] : Corrosion 5è éd., vol. 13 de ASM Handbook, éd. ASM International (American Society for Materials), 1996
- [Ben62] : L'Oxydation des métaux, J. Bénard et coll., éd. Gauthier-Villars, 1962
- [Kof88] : High Temperature Corrosion in metallic superfices, P. Kofstad, éd. Elsevier, 1988
- [Lan93] : Corrosion et chimie de surfaces des métaux, D. Landolt, vol. 12 de Traité des matériaux, éd. Presses Polytechniques et Universitaires Romandes, 1993
- [Now92] : Diffusion in Solids and High Temperature Oxidation of Metals, éditeur J. Nowotny, éd. Trans Tech Publications, 1992
- [Phi98] : Métallurgie : du minerai au matériau, J. Philibert et coll., éd. Masson, 1998
Enlaces externos
- iSERCOM Anticorrosive material producer
 Wikimedia Commons alberga contenido multimedia sobre corrosión. Commons
Wikimedia Commons alberga contenido multimedia sobre corrosión. Commons
Categoría:- Procesos químicos
Wikimedia foundation. 2010.