- Dihidrolipoil deshidrogenasa
-
Dihidrolipoil deshidrogenasa
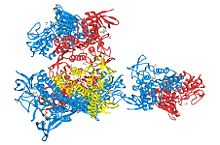
Estructura 3D de tres unidades de dihidrolipoildeshidrogenasa. PDB 1ZMC. Dihidrolipoil deshidrogenasaIdentificadores Símbolo DLD Símbolos alt. LAD, GCSL, DLDH Entrez 1738 HUGO 2898 OMIM 238331 PDB 1ZMC RefSeq NM_000108 UniProt P09622 Otros datos Número EC 1.8.1.4 Locus Cr. 7 q31-q32 La enzima Dihidrolipoil deshidrogenasa (DLD) EC 1.8.1.4, cataliza la reacción de oxidación del NADH a NAD+ reduciendo al mismo tiempo la dihidroxilipoil-lisina unida a una proteína a lipoil-lisina. Esta enzima utiliza como cofactor el FAD.
- Proteína N(6)-(dihidroxilipoil) lisina + NAD+
 Proteína N(6)-(lipoil) lisina + NADH
Proteína N(6)-(lipoil) lisina + NADH
También puede usar dihidrolipoato, dihidrolipoamida y dihidrolipoil-lisina libres como sustratos. Esta enzima se descubrió por su catálisis de la oxidación del NADH por el azul de metileno llamándose por entonces diaforasa.
Esta enzima esta presente en la matriz mitocondrial en forma de homodímero utilizando una molécula FAD por cada uno. El sitio activo es un enlace disulfuro activo para reacciones redox.
Contenido
Complejo enzimático 2-oxoglutarato deshidrogenasa
La DLD forma parte del complejo multienzimático 2-oxoglutarato deshidrogenasa en la que múltiples copias de la alfa-cetoglutarato deshidrogenasa (E1) están unidas a un núcleo de moléculas de la dihidrolipoil-lisina-residuo succiniltransferasa (E2) que a su vez también se une a varias moléculas de la dihidrolipoil deshidrogenasa (E3). El complejo 2-oxoglutarato deshidrogenasa cataliza la conversión global del 2-oxoglutarato a succinil-CoA y dióxido de carbono (quinta reacción del ciclo de Krebs).
Sistema de segmentación de la glicina
La DLD forma parte del sistema de segmentación de la glicina en donde se llama Proteína L. Las otras enzimas/proteínas constituyentes de este complejo son:
- Proteína P. Glicina deshidrogenasa.
- Proteína T. Aminometiltransferasa.
- Proteína H. P23434.
Otros complejos
La DLD está presente en el complejo piruvato deshidrogenasa uniéndose al núcleo de dihidrolipoil-lisina-residuo acetiltransferasa y cataliza la oxidación de sus grupos dihidrolipoilo. La DLD también participa en el complejo 3-metil-2-oxobutanoato deshidrogenasa realizando funciones similares que en el 2-oxoglutarato deshidrogenasa.
Enfermedades
La deficiencia en DLD es causa de la acidosis láctica congénita infantil y de la enfermedad de orina con olor a jarabe de arce (Maple Syrup Urine Disease MSUD). La MSUD está caracterizada por retardo físico y mental, problemas de alimentación y olor a jarabe de arce en la orina. Los cetoácidos de los aminoácidos de cadena ramificada están presentes en la orina, resultando esto por un bloqueo en la descarboxilación oxidativa.
Enlaces externos
- NiceZyme (en inglés).
Categorías: Genes del cromosoma 7 | Oxidorreductasas - Proteína N(6)-(dihidroxilipoil) lisina + NAD+
Wikimedia foundation. 2010.
