- Ecuación de Nernst
-
Ecuación de Nernst
La ecuación de Nernst se utiliza para calcular el potencial de reducción de un electrodo cuando las condiciones no son las estándar (concentración 1 M, presión de 1 atm, temperatura de 298K ó 25ºC).
Contenido
Ecuación
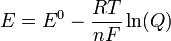
Donde E es el potencial corregido del electrodo, E0 el potencial en condiciones estándar (los potenciales se encuentran tabulados para diferentes reacciones de reducción), R la famosa constante de los gases, T la temperatura absoluta (escala Kelvin), n la cantidad de moles de electrones que participan en la reacción, F la constante de Faraday (aproximadamente 96500 Coulomb/mol), y Q la siguiente expresión para la reacción a a A + b B → c C + d D:
![Q = \frac{[C]^c[D]^d}{[A]^a[B]^b}](/pictures/eswiki/51/31fa6074207573fc23aa611c361f00a9.png)
Donde "[C]" y "[D]" son las presiones parciales y/o concentraciones molares en caso de gases o de iones disueltos, respectivamente, de los productos de la reacción; "[A]" y "[B]" ídem para los reactivos. Los exponentes son la cantidad de moles de cada sustancia implicada en la reacción (coeficientes estequiométricos). A las sustancias en estado sólido se les asigna concentración unitaria, por lo que no aparecen en Q.
En realidad, los potenciales de las células electroquímicas están relacionados con las actividades de los reactivos y los productos de la reacción, que a su vez están relacionadas con las respectivas concentraciones molares. No obstante, con frecuencia se hace la aproximación de que las actividades son iguales a las concentraciones molares, pero es conveniente tener en cuenta que esto es una aproximación y que como tal, puede conducir a resultados erroneos. Para una reacción genérica:
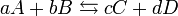
La constante de equilibrio para esta reacción viene dada por:
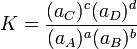
Donde
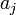 es la actividad de la especie "j"
es la actividad de la especie "j"Además se define Q como:
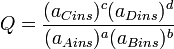
Donde el subíndice "
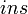 " indica que las actividades son instantáneas y no las actividades de equilibrio. Por tanto, Q no es una constante, sino que está cambiando de forma continua hasta que se alcanza el equilibrio y entonces Q = K El máximo trabajo que puede obtenerse, a presión y temperatura constantes, de una celda viene dado por la variación de energía libre, ΔG
" indica que las actividades son instantáneas y no las actividades de equilibrio. Por tanto, Q no es una constante, sino que está cambiando de forma continua hasta que se alcanza el equilibrio y entonces Q = K El máximo trabajo que puede obtenerse, a presión y temperatura constantes, de una celda viene dado por la variación de energía libre, ΔG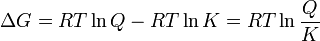
Por otra parte, el potencial de celda se relaciona con la variación de energía libre mediante la ecuación:
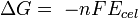
Donde
"
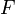 " es 96485 culombios por mol de electrones y "n" es el número de electrones asociados al proceso
" es 96485 culombios por mol de electrones y "n" es el número de electrones asociados al proceso
Combinando las dos ecuaciones anteriores se obtiene: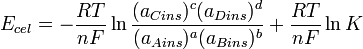
El término "
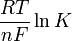 " se denomina potencial estandar de electrodo de celda,
" se denomina potencial estandar de electrodo de celda, 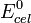
Por lo que, la ecuación de Nernst queda:
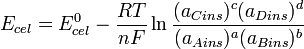
Como puede observarse, cuando los reactivos y productos tienen valores de actividad tales que Q = 1, entonces el potencial de celda es igual al potencial estandar. Aproximando la actividad a concentración molar y teniendo en cuenta que los valores de concentración son instantáneos se obtiene la expresión:
![E_{cel} = E_{cel}^0 - ln \frac{[C]^c[D]^d}{[A]^a[B]^b}](/pictures/eswiki/48/01fe2d07c23af02fb9b0ae731a7b09ec.png)
Aplicación a pilas
La fuerza electromotriz de una pila se calcula con la siguiente expresión:
ΔE = ERedCatodo − ERedAnodo
Ambos potenciales de reducción se calculan con la ecuación de Nernst, por lo tanto sacando factor común y operando con los logaritmos se obtiene la siguiente ecuación:
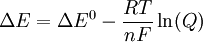
Donde "ΔE" es la diferencia de potencial corregida de la pila y "ΔE0 la diferencia de potencial de la pila en condiciones estándar, es decir calculada con las reacciones tabuladas, sin corregir con la ecuación de Nernst para electrodos.
Ejemplo de aplicación
En la pila de reacción
 se intercambian 6 electrones, por lo tanto n = 6 y
se intercambian 6 electrones, por lo tanto n = 6 y ![Q = \frac{[Al^{3+}]^2}{[Zn^{2+}]^3}](/pictures/eswiki/97/a837ae46059a940b8e203ffeac621b22.png)
Donde [ ] denota concentración.
Si sólo se busca el potencial corregido del cátodo (reducción) entonces
![Q = \frac{1}{[Zn^{2+}]^3}](/pictures/eswiki/52/47994253d581a89f8837ded2bfe9f73e.png) debido a que la reacción de reducción tiene como producto Zn sólido, al cual se le asigna concentración unitaria.
debido a que la reacción de reducción tiene como producto Zn sólido, al cual se le asigna concentración unitaria.Simplificación por temperatura estándar
Para T = 298K la ecuación se reduce a:
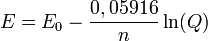
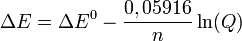
Estas versiones simplificadas son las más utilizadas para electrodos y pilas a temperatura ambiente puesto que el error que se produce por diferencias entre la temperatura real y la expresada en la ecuación es desestimable.
Unidades
Las unidades del potencial de reducción se expresan en voltios (V).
Las concentraciones no incluyen las unidades, por lo que el argumento del logaritmo es adimensional.
Categorías: Leyes electromagnéticas | Electroquímica
Wikimedia foundation. 2010.
