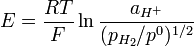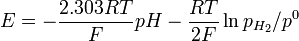- Electrodo estándar de hidrógeno
-
Electrodo estándar de hidrógeno
Un electrodo estándar de hidrógeno también llamado electrodo normal de hidrógeno es un electrodo redox que forma la base de la tabla estándar de potenciales de electrodos. Su potencial absoluto se estima en 4.44 ± 0.02 a 25 °C, pero para realizar una base de comparación con cualquier otra reacción electrolítica, el potencial electrolítico del hidrógeno (E0) se fija como 0 en todas las temperaturas.[1]
Los potenciales de cualquier otro electrodo se compara con el estándar a la misma temperatura.
El electrodo de hidrógeno se basa en la semicelda redox:
- 2H+(aq) + 2e- → H2(g)
Esta reaccion de oxidación-reducción ocurre en un electrodo de platino.
El electrodo es sumergido en una solución ácida y se bombe hidrógeno gasesoso a través de el. La concentración de formas oxidadas y reducidas se mantiene como una unidad. Esto implica que la presión de hidrógeno gaseoso es igual a 1 bar y la concentración de hidrógeno en la solucion es 1 mol.
La ecuación de Nernst debe desarrollarse así:
o
donde:
- aH+ es la actividad de los iones de hidrógeno, aH+=fH+ CH+ /C0
- pH2 es la presión parcial del hidrógeno gaseoso , en pascales, Pa
- R es la constante universal de los gases ideales
- T es la temperatura, en grados Kelvin.
- F es la constante de Faraday (carga por mol de electrones), igual a 9.6485309*104 C mol-1
- p0 es la presión estádard 105 en Pa
Contenido
¿Porqué platino?
El uso de platino para el electrodo de hidrógeno se debe a varios factores:
- Material inerte, que no se corroe.
- Capacidad para catalizar la reacción de reducción de protones.
- Alto intercambio intrínseco de densidad para la reducción de protones.
- excelente reproducción del potencial (igual o menor que 10 μV cuando dos electrodos bien construídos se comparan con otros.[2]
La superficie del platino se platiniza, es decir, se cubre con una capa de negro de platino por lo que se requiere:
- Emplear un electrodo con gran superficie real. Cuanto mayor es la superficie real, mayor es la cinética del electrodo.
- Emplear un material que pueda absorber hidrógeno como interface. La platinización mejora el rendimiento del electrodo.
Sin embargo, otros metales pueden utilizarse para construir electrodos de utilidad similar, por ejemplo paladio.
Comparación de la densidad de intercambio normal para la reacción de reducción de protones en 1 mol/kg H2SO4[2] MATERIAL DEL ELECTRODO Densidad de
intercambio
normal
-log10(A/cm2)Paladio 3.0 Platino 3.1 Rodio 3.6 Iridio 3.7 Níquel 5.2 Oro 5.4 Tungsteno 5.9 Niobio 6.8 Titanio 8.2 Cadmio 10.8 Manganeso 10.9 Plomo 12.0 Mercurio 12.3 Interferencia
A causa de la alta actividad de absorción del electrodo platinizado es muy importante proteger la superficie del mismo y la solución contra la presencia de sustancias orgánicas o de oxígeno de la atmósfera. Los iones inorgánicos que pueden reducir a un estado de valencia mas baja también deben ser evitados (por ejemplo Fe3+, CrO42-).
Los cationes que pueden reducir un depósito sobre el platino también pueden ser fuente de interferencia: plata, mercurio, cobre, plomo, cadmio y talio.
Las sustancias que pueden desactivar la catálisis incluyen al arsénico, sulfitos y otros compuestos de azufre, sustancias coloidales, alcaloides, y material biológico en general.[3]
Construcción
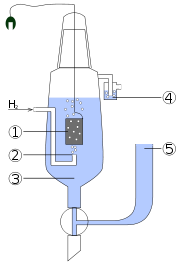
Esquema de un electrodo estándar de hidrógeno:
- Electrodo de platino platinizado.
- Bombeo de hidrógeno.
- Solución ácida con actividad de H+ = 1 mol kg-1
- Sifón para prevenir la interferencia de oxígeno.
- Depósito a traves del cual puede conectarse el segundo semielemento de la celda galvánica. Esto crea una conexión de conductividad iónica hacia el electrodo de interés.
Referencias
- Todo o parte de este artículo fue creado a partir de la traducción del artículo Standard hydrogen electrode de la Wikipedia en inglés, bajo licencia Creative Commons Compartir Igual 3.0. y GFDL.
- ↑ LIbro de oro IUPAC
- ↑ a b D.T. Sawyer, A. Sobkowiak, J.L. Roberts, Jr., "Electrochemistry for Chemists, 2nd edition", John Wiley and Sons, Inc., 1995.
- ↑ D.J.G. Ives, G.J. Janz, "Reference Electrodes. Theory and Practice", Academic Press, 1961.
Categorías: Electrodos | Electroquímica
Wikimedia foundation. 2010.