- Energía de activación
-
Energía de activación
La energía de activación (
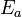 ) en química y biología es la energía que necesita un sistema antes de poder iniciar un determinado proceso. La energía de activación suele utilizarse para denominar la energía mínima necesaria para que se produzca una reacción química dada. Para que ocurra una reacción entre dos moléculas, éstas deben colisionar en la orientación correcta y poseer una cantidad de energía mínima. A medida que las moléculas se aproximan, sus nubes de electrones se repelen. Esto requiere energía (energía de activación) y proviene del calor del sistema, es decir de la energía traslacional, vibracional, etcétera de cada molécula. Si la energía es suficiente, se vence la repulsión y las moléculas se aproximan lo suficiente para que se produzca una reordenación de los enlaces de las moléculas. La ecuación de Arrhenius proporciona la base cuantitativa de la relación entre la energía de activación y la velocidad a la que se produce la reacción. El estudio de las velocidades de reacción se denomina cinética química.
) en química y biología es la energía que necesita un sistema antes de poder iniciar un determinado proceso. La energía de activación suele utilizarse para denominar la energía mínima necesaria para que se produzca una reacción química dada. Para que ocurra una reacción entre dos moléculas, éstas deben colisionar en la orientación correcta y poseer una cantidad de energía mínima. A medida que las moléculas se aproximan, sus nubes de electrones se repelen. Esto requiere energía (energía de activación) y proviene del calor del sistema, es decir de la energía traslacional, vibracional, etcétera de cada molécula. Si la energía es suficiente, se vence la repulsión y las moléculas se aproximan lo suficiente para que se produzca una reordenación de los enlaces de las moléculas. La ecuación de Arrhenius proporciona la base cuantitativa de la relación entre la energía de activación y la velocidad a la que se produce la reacción. El estudio de las velocidades de reacción se denomina cinética química.Un ejemplo particular es el que se da en la combustión de una sustancia. Por sí solos el combustible y el comburente no producen fuego, es necesario un primer aporte de energía para iniciar la combustión autosostenida. Una pequeña cantidad de calor aportada puede bastar que se desencadene una combustión, haciendo la energía calórica aportada las veces de energía de activación y por eso a veces a la energía de activación se la llama fuente de cosegracion Según el origen de este primer aporte de energía lo clasificamos como:
- Químico: La energía química exotérmica desprende calor, que puede ser empleado como fuente de ignición.
- Eléctrico: El paso de una corriente eléctrica o un chispazo produce calor.
- Nuclear: La fusión y la fisión nuclear producen calor.
- Mecánico: Por compresión o fricción, la fuerza mecánica de dos cuerpos puede producir calor.
Las siguientes representaciones gráficas manifiestan diferencias acerca de cómo la presencia de un catalizador (ejemplo una enzima) por ejemplo biológico disminuye la energia de activacion debido a su complementariedad y por tanto provoca una disminución en el tiempo requerido para que se forme el producto o sea aumenta la velocidad.
 La relación entre la energía de activación ( Ea ) y el incremento de la entalpía de formación (Δ
La relación entre la energía de activación ( Ea ) y el incremento de la entalpía de formación (Δ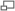
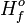 ) con y sin catalizador. El punto de mayor energía (punto del complejo activado) representa el estado de transición. Con un catalizado, la energía requerida para que la reacción entre en el estado de transición disminuye, por lo tanto, la energía necesaria para iniciar la energía también disminuye.Categorías: Propiedades químicas | Fisicoquímica | Catálisis | Cinética química | Dinámica química
) con y sin catalizador. El punto de mayor energía (punto del complejo activado) representa el estado de transición. Con un catalizado, la energía requerida para que la reacción entre en el estado de transición disminuye, por lo tanto, la energía necesaria para iniciar la energía también disminuye.Categorías: Propiedades químicas | Fisicoquímica | Catálisis | Cinética química | Dinámica química
Wikimedia foundation. 2010.
