- Geometría molecular
-
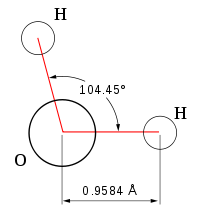 Geometría de la molécula de agua.
Geometría de la molécula de agua.
La geometría molecular o estructura molecular se refiere a la disposición tri-dimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, como son la reactividad, polaridad, fase, color, magnetismo, actividad biológica, etc. Actualmente, el principal modelo de geometría molecular es la Teoría de Repulsión de Pares de Electrones de Valencia (TRePEV), empleada internacionalmente por su gran predictibilidad.
Contenido
Determinación de la geometría molecular
Las geometrías moleculares se determinan mejor a temperaturas próximas al cero absoluto porque a temperaturas más altas las moléculas presentarán un movimiento rotacional considerable. En el estado sólido la geometría molecular puede ser medida por Difracción de rayos X. Las geometrías se pueden calcular por procedimientos mecánico cuánticos ab initio o por métodos semiempíricos de modelamiento molecular. Las moléculas grandes a menudo existen en múltiples conformaciones estables que difieren en su geometría molecular y están separadas por barreras altas en la superficie de energía potencial.
La posición de cada átomo se determina por la naturaleza de los enlaces químicos con los que se conecta a sus átomos vecinos. La geometría molecular puede describirse por las posiciones de estos átomos en el espacio, mencionando la longitud de enlace de dos átomos unidos, ángulo de enlace de tres átomos conectados y ángulo de torsión de tres enlaces consecutivos.
Movimiento atómico
Dado que el movimiento de los átomos en una molécula está determinado por la mecánica cuántica, uno debe definir el "movimiento" de una manera cuántica.
Los movimientos cuánticos (externos) de traslación y rotación cambian fuertemente la geometría molecular. (En algún grado la rotación influye en la geometría por medio de la fuerza de Coriolis y la distorsión centrífuga, pero son despreciables en la presente discusión).
Un tercer tipo de movimiento es la vibración, un movimiento interno de los átomos en una molécula. Las vibraciones moleculares son armónicas (al menos en una primera aproximación), lo que significa que los átomos oscilan en torno a su posición de equilibrio, incluso a la temperatura del cero absoluto. En el cero absoluto todos los átomos están en su estado vibracional basal y muestran movimiento mecánico cuántico de punto cero, esto es, la función de onda de un modo vibracional simple no es un pico agudo, sino un exponencial de ancho finito. A temperaturas mayores, los modos vibracionales pueden ser excitados térmicamente (en un interpretación clásica, esto se expresa al enunciar que "las moléculas vibrarán más rápido"), pero siempre oscilan alrededor de una geometría reconocible para la molécula.
Para tener una comprensión más clara de la probabilidad de que la vibración de una molécula pueda ser térmicamente excitada, se inspecciona el factor de Boltzmann
 , donde ΔE es la energía de excitación del modo vibracional, k es la constante de Boltzmann y T es la temperatura absoluta. A 298K (25 °C), unos valores típicos del factor de Boltzmann son: ΔE = 500 cm-1 --> 0.089; ΔE = 1000 cm-1 --> 0.008; ΔE = 1500 cm-1 --> 7 10-4. Esto es, si la energía de excitación es 500 cm-1, aproximadamente el 9% de las moléculas están térmicamente excitadas a temperatura ambiente. La menor energía vibracional de excitación es el modo de flexión (aproximadamente 1600 cm-1). En consecuencia, a temperatura ambiente menos del 0,07% de todas las moléculas de una cantidad dada de agua vibrarán más rápido que en el cero absoluto.
, donde ΔE es la energía de excitación del modo vibracional, k es la constante de Boltzmann y T es la temperatura absoluta. A 298K (25 °C), unos valores típicos del factor de Boltzmann son: ΔE = 500 cm-1 --> 0.089; ΔE = 1000 cm-1 --> 0.008; ΔE = 1500 cm-1 --> 7 10-4. Esto es, si la energía de excitación es 500 cm-1, aproximadamente el 9% de las moléculas están térmicamente excitadas a temperatura ambiente. La menor energía vibracional de excitación es el modo de flexión (aproximadamente 1600 cm-1). En consecuencia, a temperatura ambiente menos del 0,07% de todas las moléculas de una cantidad dada de agua vibrarán más rápido que en el cero absoluto.Como se mencionó anteriormente, la rotación influye fuertemente sobre la geometría molecular. Pero, como movimiento mecánico cuántico, se excita a bajas temperaturas (comparada con la vibración). Desde un punto de vista clásico, puede decirse que más moléculas rotan más rápidamente a temperatura ambiente, esto es que tienen mayor velocidad angular y momentum angular. En lenguaje de mecánica cuántica: más "eigenstates" de alto momentum angular son poblados térmicamente al aumentar la temperatura. Las energías de excitación rotacionales típicas están en el orden de unos pocos cm-1.
Los resultados de muchos experimentos espectroscópicos están ensanchados porque involucran una media de varios estados rotacionales. Frecuentemente es difícil obtener las geometrías a partir de los espectros a altas temperaturas, porque el número de estados rotacionales rastreados en el experimento aumenta al incrementarse la temperatura. En consecuencia, muchas observaciones espectroscópicas sólo se puede esperar que conduzcan a geometrías moleculares confiables a temperaturas cercanas al cero absoluto.
Enlaces atómicos
Por definición, los átomos en las moléculas suelen estar unidos unos a otros con enlaces covalentes, que pueden ser simples, dobles o triples, donde un "enlace" es un par de electrones compartidos entre átomos vecinos. Otro método de unión entre átomos se denomina enlace iónico en el que intervienen cationes positivos y aniones negativos, sin que se forman moléculas sino redes iónicas.
La geometría molecular puede ser especificada en términos de longitud de enlace, ángulo de enlace y ángulo torsional. La longitud de enlace está definida como la distancia media entre los centros de dos átomos enlazados en una moléculada dada. Un ángulo de enlace es el ángulo formado por tres átomos enlazados consecutivamente. Para cuatro átomos unidos consecutivamente en una cadena línea, el ángulo torsional es el ángulo entre el plano formado por los tres primeros átomos y el plano formado por los tres últimos átomos.
Isómeros
Los isómeros son tipos de moléculas que comparten la misma fórmula química, pero que tienen diferentes geometrías, resultando en propiedades muy distintas:
- Una sustancia "pura" está compuesta de sólo un tipo de isómero de una molécula (todas tienen la misma estructura geométrica).
- Los isómeros estructurales tienen la misma fórmula química, pero diferente ordenamiento físico, frecuentemente formando geometrías moleculares alternas con propiedades muy diferentes. Los átomos no están enlazados (conectados) en el mismo orden.
- Los isómeros funcionales son una clase especial de isómeros estructurales, donde ciertos grupos de átomos exhiben un tipo especial de comportamiento, como es un éter o un alcohol.
- La estereoisómeros pueden tener muchas propiedades físicoquímicas idénticas y, al mismo tiempo, actividad biológica muy diferente. Esto se debe a que poseen la quiralidad que es muy común en los sistemas vivientes. Una manifestación de esta quiralidad es su habilidad para hacer rotar la luz polarizada en direcciones diferentes.
- Protein folding, que concierne a la compleja geometría y diferentes isómeros que las proteínas pueden tener.
La geometría molecular se representa en una pirámide en la cual en la punta inicial hay una molécula de oxígeno con carga negativa, quedando en las otras dos puntas dos moléculas de hidrógeno con carga positiva, que son separadas por un ángulo de 104.5º; el enlace que une los hidrógenos con el oxígeno se llama enlace covalente, y también existe un enlace que une a otra pirámide idéntica a la anteriormente nombrada llamado enlace puente hidrógeno.
Tipos de estructura molecular
Tipo de molécula Forma Disposición electrónica† Geometría‡ Ejemplos AX1En Molécula diatómica 
HF, O2 AX2E0 Lineal 
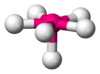
Angular 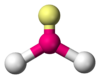
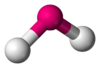
NO2−, SO2, O3 AX2E2 Angular 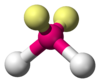
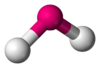
H2O, OF2 AX2E3 Lineal 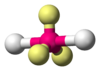

Trigonal plana 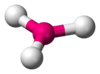
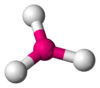
BF3, CO32−, NO3−, SO3 AX3E1 Pirámide trigonal 
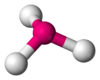
NH3, PCl3 AX3E2 Forma de T 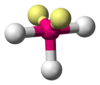
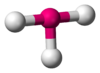
Tetraédrica 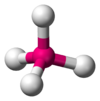
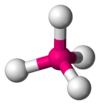
CH4, Balancín 
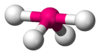
Cuadrada plana 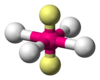
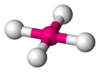
Bipirámide trigonal 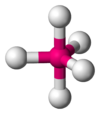

PCl5 AX5E1 Pirámide cuadrangular 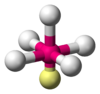
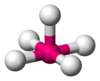
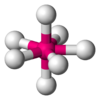
Octaédrica 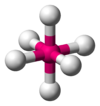
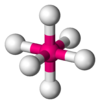
SF6 AX6E1 Pirámide pentagonal 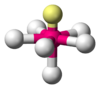
XeOF—5, IOF2-5[1] AX7E0 Bipirámide pentagonal 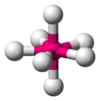
editar] Referencias Enlaces externos
- García González, Luis Ignacio (2008). «Cómo introducir la geometría molecular en 3º de la ESO». Anales de la Real Sociedad Española de Química 104 (1). ISSN=1575-3417 , pp. 47-49. http://dialnet.unirioja.es/servlet/articulo?codigo=2558239.
Wikimedia foundation. 2010.
Mira otros diccionarios:
Geometría molecular cuadrada plana — Estructura idealizada de un compuesto con una geometría de coordinación cuadrada plana La geometría molecular cuadrada plana en química describe la estereoquímica (disposición espacial de los átomos) que adoptan ciertos compuestos químicos. Como… … Wikipedia Español
Geometría molecular piramidal cuadrada — Estructura idealizada de un compuesto de coordinación con una geometría molecular piramidal cuadrada En química, la geometría molecular piramidal cuadrada describe la forma o geometría molecular de ciertos compuestos de fórmula química ML5, donde … Wikipedia Español
Geometría molecular piramidal trigonal — En química, la geometría molecular piramidal trigonal es un tipo de geometría molecular con un átomo en el vértice superior y tres átomos en las esquinas de un triángulo, en un plano inferior. Cuando los tres átomos en las esquinas son iguales,… … Wikipedia Español
Geometría molecular trigonal plana — Estructura idealizada de un compuesto de coordinación con geometría trigonal plana En química, la geometría molecular trigonal plana es un tipo de geometría molecular con un átomo en el centro y tres átomos en las esquinas de un triángulo,… … Wikipedia Español
Geometría molecular tetraédrica — Estructura ideal de una molécula teraédrica con un átomo central de color rosa. El metano (CH 4 ) es una molécula tetraédrica, con ángulos de en … Wikipedia Español
Geometría molecular bipiramidal pentagonal — Estructura idealizada de una molécula de coordinación con una geometría molecular bipiramidal pentagonal En química, la geometría molecular bipiramidal pentagonal es un tipo de geometría molecular con un átomo central unido mediante enlaces… … Wikipedia Español
Geometría molecular angular — En Química, la geometría molecular angular (también llamada en forma de V) describe la disposición de los electrones en el espacio en torno a aquellas moléculas de tipo AX2E1 o AX2E2, según la VSEPR, es decir, aquellas moléculas con dos pares de… … Wikipedia Español
Geometría molecular piramidal pentagonal — Estructura idealizada de un compuesto de coordinación con una geometría molecular piramidal pentagonal. En química, la geometría molecular piramidal pentagonal describe la geometría molecular o forma de ciertos compuestos químicos en los que seis … Wikipedia Español
Geometría molecular de balancín — Modelo de bolas de una molécula con forma de balancín. En Química, la geometría molecular de balancín (trad. del inglés, Seesaw molecular geometry) describe la disposición de cuatro átomos en torno a un átomo central con un par de electrones no… … Wikipedia Español
Geometría molecular octaédrica — Estructura idealizada de un compuesto con geometría de coordinación octaédrica. En química, se llama geometría molecular octaédrica o Oh a la forma de los compuestos en los que seis ligandos (átomos, moléculas o iones) se disponen alrededor de un … Wikipedia Español
