- Proceso isotérmico
-
Se denomina proceso isotérmico o proceso isotermo al cambio de temperatura reversible en un sistema termodinámico, siendo dicho cambio de temperatura constante en todo el sistema. La compresión o expansión de un gas ideal en contacto permanente con un termostato es un ejemplo de proceso isotermo, y puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco caliente. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
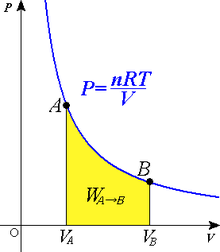
Una curva isoterma es una línea que sobre un diagrama representa los valores sucesivos de las diversas variables de un sistema en un proceso isotermo. Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P•V = constante.
Proceso isotérmico de un gas
Una expansión isotérmica es un proceso en el cual un gas se expande (o contrae), manteniendo la temperatura constante durante dicho proceso, es decir que T1 = T2 para los estados inicial (1) y final (2) del proceso isotérmico. Aplicando el primer principio de la termodinámica se obtiene:
- dQ = dU + dW
Entonces integrando la expresión anterior, tomando como estado inicial el estado 1 y estado final el estado 2, se obtiene: ..........(1)
..........(1)
Por la definición de trabajo dada en mecánica se tiene que:Pero la fuerza
 se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento
se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento  se puede escribir como dx, entonces:
se puede escribir como dx, entonces:Pero Adx equivale a dV, el aumento en el volumen del gas durante esta pequeña expansión, entonces el trabajo efectuado por el gas sobre los alrededores como resultado de la expansión es:
- dW = PAdx = PdV ..........(2)
Ahora reemplazando (1) en (2) se puede integrar:
 ..........(3)
..........(3)
Pero para integrar la tercera integral, es necesario conocer la forma de variación de la presión P con el volumen, durante el proceso tratado.
En el caso de tratar con gases ideales, se tendría la relación:
 ..........(4)
..........(4)
Por lo tanto reemplazando (4) en (3) se tiene que:
Como los valores n y R son constantes para cada gas ideal, y en este caso la temperatura también es constante, éstas pueden salir fuera de la integral obteniéndose:
Ahora integrando:
![[Q]_1^2 = [U]_1^2 + nRT[\ln V]_1^2](b/9bb7def5b45c1c793290a37d2aafc98d.png)

 ..........(5)
..........(5)
Pero se sabe que la energía interna depende sólo de la temperatura (Ver: La energía interna como función de la temperatura), y como en este proceso ésta se mantiene constante, no hay cambio en la energía interna del gas, por lo que la expresión (5) se reduce a:
Por lo tanto, en una expansión isotérmica de un gas perfecto, el calor de entrada es igual al trabajo efectuado por el gas.
Véase también
Categoría:- Procesos termodinámicos
Wikimedia foundation. 2010.