- Enfermedad de Alzheimer
-
Enfermedad de Alzheimer 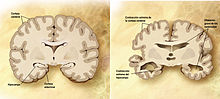
Comparación entre un cerebro normal y un cerebro afectado de Alzheimer.Clasificación y recursos externos CIE-10 G30, F00 CIE-9 331.0, 290.1 OMIM 104300 DiseasesDB 490 MedlinePlus Información de salud en la enciclopedia MedlinePlus PubMed Buscar en Medline mediante PubMed (en inglés) eMedicine neuro/13 MeSH D000544  Aviso médico
Aviso médico La enfermedad de Alzheimer (EA), también denominada mal de Alzheimer, o demencia senil de tipo Alzheimer (DSTA) o simplemente alzhéimer[1] es una enfermedad neurodegenerativa, que se manifiesta como deterioro cognitivo y trastornos conductuales. Se caracteriza en su forma típica por una pérdida progresiva de la memoria y de otras capacidades mentales, a medida que las células nerviosas (neuronas) mueren y diferentes zonas del cerebro se atrofian. La enfermedad suele tener una duración media aproximada después del diagnóstico de 10 años,[2] aunque esto puede variar en proporción directa con la severidad de la enfermedad al momento del diagnóstico.
La EA es la forma más común de demencia, es incurable y terminal, que aparece con mayor frecuencia en personas mayores de 65 años de edad.[3] Los síntomas de la enfermedad como una entidad nosológica definida fue identificada por Emil Kraepelin,[4] mientras que la neuropatología característica fue observada por primera vez por Alois Alzheimer en 1906.[5] [6] [7] Así pues, el descubrimiento de la enfermedad fue obra de ambos psiquiatras, que trabajaban en el mismo laboratorio. Sin embargo, dada la gran importancia que Kraepelin daba a encontrar la base neuropatológica de los desórdenes psiquiátricos, decidió nombrar la enfermedad alzheimer en honor a su compañero.
Por lo general, el síntoma inicial es la inhabilidad de adquirir nuevas memorias, pero suele confundirse con actitudes relacionadas con la vejez o al estrés.[8] Ante la sospecha de EA, el diagnóstico se realiza con evaluaciones de conducta y cognitivas, así como neuroimágenes, de estar disponibles.[9] A medida que progresa la enfermedad, aparecen confusión mental, irritabilidad y agresión, cambios del humor, trastornos del lenguaje, pérdida de la memoria de largo plazo y una predisposición a aislarse a medida que los sentidos del paciente declinan.[8] [10] Gradualmente se pierden las funciones biológicas que finalmente conllevan a la muerte.[11] El pronóstico para cada individuo es difícil de determinar. El promedio general es de 7 años,[12] menos del 3% de los pacientes viven por más de 14 años después del diagnóstico.[13]
La causa de la EA permanece desconocida. Las investigaciones suelen asociar la enfermedad a la aparición de placas seniles y ovillos neurofibrilares.[14] Los tratamientos actuales ofrecen moderados beneficios sintomáticos, pero no hay tratamiento que retarde o detenga el progreso de la enfermedad.[15] Para la prevención de la EA, se han sugerido un número variado de hábitos conductuales, pero no hay evidencias publicadas que destaquen los beneficios de esas recomendaciones, incluyendo estimulación mental y dieta balanceada.[16] El papel que juega el cuidador del sujeto con EA es fundamental,[17] aun cuando las presiones y demanda física de esos cuidados pueden llegar a ser una gran carga personal.[18] [19] [20]
El día internacional del Alzheimer se celebra el 21 de septiembre, fecha elegida por la OMS y la Federación internacional de Alzheimer, en la cual se celebran en diversos países actividades para concienciar y ayudar a prevenir la enfermedad.
Contenido
Historia
Los antiguos filósofos y médicos griegos y romanos asociaron a la vejez con la demencia.[7] No fue hasta 1901 que el psiquiatra alemán Alois Alzheimer identificó el primer caso de lo que se conoce hoy como enfermedad de Alzheimer, en una mujer de cincuenta años de edad, a quien llamó «Auguste D». El investigador hizo seguimiento de su paciente hasta su muerte en 1906, momento en que por primera vez reportó el caso públicamente.[21] Durante los siguientes cinco años, la literatura médica reportó al menos once casos similares, algunos de ellos utilizando ya el término enfermedad de Alzheimer.[7] La enfermedad fue categorizada por primera vez por Emil Kraepelin después de la supresión de algunos elementos clínicos concomitantes como delirios y alucinaciones, así como características histológicas irrelevantes para la enfermedad como los cambios arterioscleróticos, los cuales figuraban en el informe original sobre Auguste D.[22] En la octava edición de su libro de texto de Psiquiatría, publicado en 1910, incluyó a la enfermedad de Alzheimer, denominada también por Kraepelin demencia presenil, como un subtipo de demencia senil.[23]
Durante la mayor parte del siglo XX, el diagnóstico de la enfermedad de Alzheimer era reservada para las personas entre las edades de 45 y 65 años con síntomas de demencia. La terminología ha cambiado desde 1977 cuando, en una conferencia sobre la EA, se llegó a la conclusión de que las manifestaciones clínicas y patológicas de la demencia presenil y senil eran casi idénticas, aunque los autores también agregaron que ello no descarta la posibilidad que tuviesen causas diferentes.[24] Esto, a la larga, conllevó a que se haga el diagnóstico de la enfermedad de Alzheimer independientemente de la edad.[25] El término demencia senil del tipo Alzheimer fue empleado durante un tiempo para describir al trastorno en aquellos mayores de 65 años, mientras que la enfermedad clásica de Alzheimer se reservaba para los de edades menores. Finalmente, el término enfermedad de Alzheimer fue aprobado oficialmente en la nomenclatura médica para describir a individuos de todas las edades con un patrón de síntomas característica, curso de la enfermedad, y neuropatología comunes.[26]
Epidemiología
Tasas de incidencia de la EA
después de los 65 años de edad[27]Edad Incidencia
(nuevos casos)
por cada mil
personas-edad65–69 3 70–74 6 75–79 9 80–84 23 85–89 40 90– 69 La incidencia en estudios de cohortes, muestra tasas entre 10 y 15 nuevos casos cada mil personas al año para la aparición de cualquier forma de demencia y entre 5 - 8 para la aparición de la enfermedad de Alzheimer.[27] [28] Es decir, la mitad de todos los casos nuevos de demencia cada año son pacientes con la EA. También hay diferencias de incidencia dependiendo del sexo, ya que se aprecia un riesgo mayor de padecer la enfermedad en las mujeres, en particular entre la población mayor de 85 años.[28] [29]
La prevalencia es el porcentaje de una población dada con una enfermedad. La edad avanzada es el principal factor de riesgo para sufrir la enfermedad de Alzheimer: mayor frecuencia a mayor edad. En los Estados Unidos, la prevalencia de la EA fue de un 1,6% en el año 2000, tanto en la población general como en la comprendida entre los 65 y 74 años. Se apreció un aumento del 19% en el grupo de los 75 a los 84 años y del 42% en el mayor de 84 años de edad;[30] sin embargo, las tasas de prevalencia en las regiones menos desarrolladas del mundo son inferiores.[31] La Organización Mundial de la Salud estimó que en 2005 el 0,379% de las personas a nivel mundial tenían demencia y que la prevalencia aumentaría a un 0,441% en 2015 y a un 0,556% en 2030.[32] Por otro lado, para el año 2010 la Alzheimer's Disease International ha estimado una prevalencia de demencia del 4,7% a nivel mundial para personas con 60 años o más,[33] representando por cierto cifras al alza respecto a varios estudios publicados con anterioridad (10% superiores a las estimadas para The Lancet en 2005).[31] Otro estudio estimó que en el año 2006, un 0,4% de la población mundial (entre 0,17–0,89%; valor absoluto aproximadamente 26,6 millones o entre 11,4–59,4 millones) se vería afectado por la EA y que la prevalencia triplicaría para el año 2050.[34]
Etiología
Las causas de la enfermedad de Alzheimer (EA) no han sido completamente descubiertas. Existen tres principales hipótesis para explicar el fenómeno: el déficit de la acetilcolina, la acumulación de amiloide y/o tau y los trastornos metabólicos.
La más antigua de ellas, y en la que se basan la mayoría de los tratamientos disponibles en el presente, es la hipótesis colinérgica, la cual sugiere que la EA se debe a una reducción en la síntesis del neurotransmisor acetilcolina. Esta hipótesis no ha mantenido apoyo global por razón de que los medicamentos que tratan una deficiencia colinérgica tienen reducida efectividad en la prevención o cura del Alzheimer, aunque se ha propuesto que los efectos de la acetilcolina dan inicio a una acumulación a tan grandes escalas que conlleva a la neuroinflamación generalizada que deja de ser tratable simplemente promoviendo la síntesis del neurotransmisor.[35] [36]
Otra hipótesis propuesta en 1991,[37] se ha relacionado con el acúmulo anómalo de las proteínas beta-amiloide (también llamada amiloide Aβ) y tau en el cerebro de los pacientes con Alzheimer.[38] En una minoría de pacientes, la enfermedad se produce por la aparición de mutaciones en los genes PSEN1, PSEN2 y en el gen de la APP, localizado en el cromosoma 21. En este último caso la enfermedad aparece clásicamente en personas con el síndrome de Down (trisomía en el cromosoma 21), casi universalmente en los 40 años de vida y se transmite de padres a hijos (por lo que existen, habitualmente, antecedentes familiares de enfermedad de Alzheimer en los pacientes que desarrollan la enfermedad en edades precoces). Esa relación con el cromosoma 21, y la tan elevada frecuencia de aparición de la enfermedad en las trisomías de ese cromosoma, hacen que la teoría sea muy evidente.[39] [40]
Otro gran factor de riesgo genético es la presencia del gen de la APOE4, el cual tiende a producir una acumulación amiloide en el cerebro antes de la aparición de los primeros síntomas de la EA. Por ende, la deposición del amiloide Aβ tiende a preceder la clínica de la EA.[41] Otras evidencias parten de los hallazgos en ratones genéticamente modificados, los cuales sólo expresan un gen humano mutado, el de la APP, el cual invariablemente les causa el desarrollo de placas amiloides fibrilares.[42] Se descubrió una vacuna experimental que causaba la eliminación de estas placas pero no tenía efecto sobre la demencia.[43]
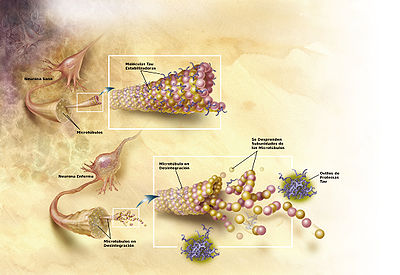
Los depósitos de las placas no tienen correlación con la pérdida neuronal.[44] Esta observación apoya la hipótesis tau, la cual defiende que es esta proteína la que da inicio a la cascada de trastornos de la enfermedad de Alzheimer.[38] De acuerdo a este modelo, las tau hiperfosforiladas adoptan formas anómalas distribuyéndose en largas hileras. Eventualmente forman ovillos de neurofibrillas dentro de los cuerpos de las células nerviosas.[45] Cuando esto ocurre, los microtúbulos se desintegran colapsando el sistema de transporte de la neurona. Ello puede dar inicio a las primeras disfunciones en la comunicación bioquímica entre una neurona y la otra y conllevar a la muerte de estas células.[46]
Un número de investigaciones recientes ha relacionado la demencia,[47] incluyendo la enfermedad de Alzheimer,[48] con desórdenes metabólicos,[49] particularmente con la hiperglicemia y la resistencia a la insulina. La expresión de receptores de la insulina ha sido demostrada en las neuronas del sistema nervioso central, preferentemente en las del hipocampo. En estas neuronas, cuando la insulina se une a su receptor celular, se promueve la activación de cascadas de señalización intracelular que conducen al cambio de la expresión de los genes relacionados con los procesos de plasticidad sináptica y de las enzimas relacionadas con el despeje de la misma insulina y del beta-amiloide. Estas enzimas degradantes de insulina promueven la disminución de la toxicidad debida al amiloide en modelos animales.
Algunos estudios han sugerido una hipótesis sobre la relación de esta enfermedad con el aluminio. Dicha hipótesis sugiere que los utensilios de aluminio contaminan con trazas de iones alúmina en los alimentos. Estos iones se focalizan en los receptores produciendo degradación y formación de plaquetas amiloide, este hecho está siendo propuesto en los centros de investigación de la enfermedad.[50] A pesar de la polémica existente en torno al papel que tiene el aluminio como factor de riesgo de la EA, en los últimos años los estudios científicos han mostrado que este metal podría estar relacionado con el desarrollo de la enfermedad. Los resultados muestran que el aluminio se asocia a varios procesos neurofisiológicos que provocan la característica degeneración de la EA.[51]
Patogenia
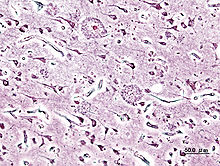 Imagen histopatológica de placas seniles vista en la corteza cerebral de un paciente con la enfermedad de Alzheimer. Impregnación con plata.
Imagen histopatológica de placas seniles vista en la corteza cerebral de un paciente con la enfermedad de Alzheimer. Impregnación con plata.
La enfermedad de Alzheimer se caracteriza por la pérdida de neuronas y sinapsis en la corteza cerebral y en ciertas regiones subcorticales. Esta pérdida resulta en una atrofia de las regiones afectadas, incluyendo una degeneración en el lóbulo temporal y parietal y partes de la corteza frontal y la circunvolución cingulada.[36]
Neuropatología
Las placas son depósitos densos, insolubles, de la proteína beta-amiloide y de material celular que se localizan fuera y alrededor de las neuronas. Estas continúan creciendo hasta formar fibras entretejidas dentro de la célula nerviosa, los llamados ovillos. Es probable que muchos individuos, en su vejez, desarrollen estas placas y ovillos como parte del proceso normal de envejecimiento, sin embargo, los pacientes con Alzheimer tienen un mayor número en lugares específicos del cerebro como el lóbulo temporal.[52]
Bioquímica
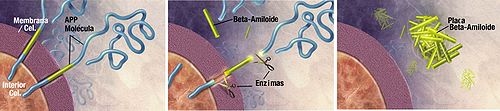 Enzimas actuando sobre la proteína precursora de Amiloides (APP) cortándola en fragmentos de beta-amiloide, los cuales son indispensables para la formación de las placas seniles del Alzheimer.
Enzimas actuando sobre la proteína precursora de Amiloides (APP) cortándola en fragmentos de beta-amiloide, los cuales son indispensables para la formación de las placas seniles del Alzheimer.
La enfermedad de Alzheimer se ha definido como una enfermedad que desdobla proteínas o proteopatía, debido a la acumulación de proteínas Aβ y tau, anormalmente dobladas, en el cerebro.[53] Las placas neuríticas están constituidas por pequeños péptidos de 39–43 aminoácidos de longitud, llamados beta-amiloides (abreviados A-beta o Aβ). El beta-amiloide es un fragmento que proviene de una proteína de mayor tamaño conocida como Proteína Precursora de Amiloide (APP, por sus siglas en inglés). Esta proteína es indispensable para el crecimiento de las neuronas, para su supervivencia y su reparación post-injuria.[54] [55] En la enfermedad de Alzheimer, un proceso aún desconocido es el responsable de que la APP sea dividida en varios fragmentos de menor tamaño por enzimas que catalizan un proceso de proteolisis.[56] Uno de estos fragmentos es la fibra del beta-amiloide, el cual se agrupa y deposita fuera de las neuronas en formaciones microscópicamente densas conocidas como placas seniles.[14] [57]
La enfermedad de Alzheimer se considera también una tauopatía, debido a la agregación anormal de la proteína tau. Las neuronas sanas están compuestas por citoesqueleto, una estructura intracelular de soporte, parcialmente hechas de microtúbulos. Estos microtúbulos actúan como rieles que guían los nutrientes y otras moléculas desde el cuerpo hasta los extremos de los axones y viceversa. Cada proteína tau estabiliza los microtúbulos cuando es fosforilado y por esa asociación se le denomina proteína asociada al microtúbulo. En la EA, la tau procede por cambios químicos que resultan en su hiperfosforilación, se une con otras hebras tau creando ovillos de neurofibrillas y, de esta manera, desintegra el sistema de transporte de la neurona.[58]
Patología
No se ha explicado por completo cómo la producción y agregación de los péptidos Aβ juegan un rol en la EA.[59] La fórmula tradicional de la hipótesis amiloide apunta a la acumulación de los péptidos Aβ como el evento principal que conlleva la degeneración neuronal. La acumulación de las fibras amiloides, que parece ser la forma anómala de la proteína responsable de la perturbación de la homeostasis del ion calcio intracelular, induce la muerte celular programada, llamada apoptosis.[60] Se sabe también, que la Aβ se acumula selectivamente en las mitocondrias de las células cerebrales afectadas en el Alzheimer y que es capaz de inhibir ciertas funciones enzimáticas, así como alterar la utilización de la glucosa por las neuronas.[61]
Varios mecanismos inflamatorios y la intervención de las citoquinas pueden también jugar un papel en la patología de la enfermedad de Alzheimer. La inflamación es el marcador general de daño en los tejidos en cualquier enfermedad y puede ser secundario al daño producido por la EA, o bien, la expresión de una respuesta inmunológica.[62]
Genética
La gran mayoría de los pacientes de esta enfermedad tienen o han tenido algún familiar con dicha enfermedad. También hay que decir que una pequeña representación de los pacientes de Alzheimer es debido a una generación autosomal dominante, haciendo que la enfermedad aparezca de forma temprana. En menos de un 10% de los casos, la EA aparece antes de los 60 años de edad como consecuencia de mutaciones autosómicas dominantes, representando, apenas, un 0,01% de todos los casos.[63] [64] [65] Estas mutaciones se han descubierto en tres genes distintos: el gen de la proteína precursora de amiloide (APP) y los genes de las presenilinas 1 y 2.[63] Si bien la forma de aparición temprana de la enfermedad de Alzheimer ocurre por mutaciones en tres genes básicos, la forma más común no se ha podido explicar con un modelo puramente genético. La presencia del gen de la apolipoproteína E es el factor de riesgo genético más importante para padecer Alzheimer, pero no permite explicar todos los casos de la enfermedad.[63]
En 1987, se descubrió la relación de la enfermedad de Alzheimer con el cromosoma 21. Esto fue importante porque la mayoría de los afectados por el "síndrome de Down" o trisomía del cromosoma 21, padecen lesiones neuropatológicas similares a las del Alzheimer. Dentro del cromosoma 21 encontramos el gen PPA. Sin embargo, John Hardy y sus colaboradores en 1991 afirmaron que el gen PPA causa la Enfermedad de Alzheimer en un reducido número de familias. Sin embargo, se considera que de entre 5-10% de los familiares con la enfermedad precoz es debido a una mutación de este gen. Las investigaciones dentro de este gen se han centrado en el péptido Ab (todas las mutaciones se encuentran alrededor de este péptido). Las mutaciones producían un aumento de las concentraciones del péptido Ab. Esto llevó a la formación de la hipótesis de "cascada amiloide" en los años 90. La "cascada ameloide" consiste en que la gran producción de Ab llevaría a la formación de depósitos en formas de placas seniles. Estas placas seniles serían nocivas para las células que producirían ovillos neurofibrilares, la muerte celular y la demencia. Más tarde se vio en un grupo amplio de familias el ligamiento de la enfermedad del Alzheimer con el cromosoma 14. Pero esto llevó a una cadena de errores y con ello unas conclusiones erróneas. Rudy Tanzi y Peter St George-Hyslop en 1995, mediante las técnicas de clonaje descubrieron otro gen S182 o Presenilin-1 (PS1). Este gen se encuentra entre los dominio 9 y 8 de transmembrana (con dos regiones hidrofílicas). A este gen se le atribuyó más de 30 mutaciones. Este gen interviene en procesos de apoptosis y es fundamental durante el desarrollo. La mayoría de las mutaciones del gen Presenilin-1 (PS1) provocan un cambio en la estructura primaria. La PS1 y la enfermedad del Alzheimer no tienen una clara relación, pero hay que destacar los pacientes que tuvieron mutaciones que aumentan Ab en el plasma. Poco más tarde se descubrió un nuevo gen que se denomina presenilina-2 (PS2) y también provoca el ascenso en la concentración de Ab, aunque las mutaciones observadas son de menor cantidad que los otros genes (PPA y PS1) La PS2 está formada por 8-9 dominios transmembrana.
La mayoría de las mutaciones en el gen de la APP y en los de las presenilinas, aumentan la producción de una pequeña proteína llamada beta-amiloide (Abeta 2), la cual es el principal componente de las placas seniles.[66]
Aunque la mayoría de los casos de Alzheimer no se deben a una herencia familiar, ciertos genes actúan como factores de riesgo. Un ejemplo es la transmisión familiar del alelo e4 del gen de la apolipoproteína E. Este gen se considera un factor de riesgo para la aparición de Alzheimer esporádico en fases tardías produciendo un 50% de los casos Alzheimer.[67] Además de éste, alrededor de 400 genes han sido también investigados por su relación con el Alzheimer esporádico en fase tardía.[68] Así pues, los genetistas coinciden en que hay más genes que actúan como factores de riesgo, aunque también afirman que existen otros que tienen ciertos efectos protectores que conllevan a retrasar la edad de la aparición del Alzheimer.[63] Un ejemplo es la alteración en el gen de la reelina, que contribuye a aumentar el riesgo de aparición de la EA en mujeres.[69]
Sin embargo, un gen asociado a las formas tardías es de Apolipoproteína E, cuya función es el transporte de colesterol
Cuadro clínico
Predemencia
Los primeros síntomas, con frecuencia, se confunden con la vejez o estrés en el paciente.[8] Una evaluación neuropsicológica detallada es capaz de revelar leves dificultades cognitivas hasta 8 años antes de que la persona cumpla los criterios de diagnóstico.[70] Estos signos precoces pueden tener un efecto sobre las actividades de la vida diaria.[71] La deficiencia más notable es la pérdida de memoria, manifestada como la dificultad de recordar hechos recientemente aprendidos y una inhabilidad para adquirir nueva información.[72] [73] [74] Dificultades leves en las funciones ejecutivas—atención, planificación, flexibilidad y razonamiento abstracto— o trastornos en la memoria semántica—el recordar el significado de las cosas y la interrelación entre los conceptos—pueden también ser síntomas en las fases iniciales de la EA.[75] [76] Puede aparecer apatía, siendo uno de los síntomas neuropsiquiátricos persistentes a lo largo de la enfermedad.[77] [78] [79] La fase preclínica de la enfermedad es denominada por algunos deterioro cognitivo leve,[80] pero aún existe debate si el término corresponde a una entidad diagnóstica independiente o si, efectivamente, es el primer estadio de la enfermedad.[81]
Demencia inicial
Los síntomas en esta fase inicial van desde una simple e insignificante, pero a veces recurrente, pérdida de memoria (como la dificultad en orientarse uno mismo en lugares como calles al estar conduciendo el automóvil), hasta una constante y más persuasiva pérdida de la memoria conocida como memoria a corto plazo, presentando dificultades al interactuar en áreas de índole familiar como el vecindario donde el individuo habita.
Además de la recurrente pérdida de la memoria, una pequeña porción de los pacientes presenta dificultades para el lenguaje, el reconocimiento de las percepciones—agnosia—o en la ejecución de movimientos—apraxia—con mayor prominencia que los trastornos de la memoria.[82] La EA no afecta las capacidades de la memoria de la misma forma. La memoria a largo plazo o memorias episódicas, así como la memoria semántica o de los hechos aprendidos y la memoria implícita, que es la memoria del cuerpo sobre cómo realizar las acciones (tales como sostener el tenedor para comer), se afectan en menor grado que las capacidades para aprender nuevos hechos o el crear nuevas memorias.[83] [84]
Los problemas del lenguaje se caracterizan, principalmente, por una reducción del vocabulario y una disminución en la fluidez de las palabras, lo que conlleva a un empobrecimiento general del lenguaje hablado y escrito. Usualmente, el paciente con Alzheimer es capaz de comunicar adecuadamente las ideas básicas.[85] [86] [87] También aparece torpeza al realizar tareas motoras finas, tales como escribir, dibujar o vestirse, así como ciertas dificultades de coordinación y de planificación.[88] El paciente mantiene su autonomía y sólo necesita supervisión cuando se trata de tareas complejas.[82]
En esta etapa es frecuente que la persona se desoriente en la calle y llegue a perderse, por lo que se recomienda tomar precauciones:
- Colocando en su muñeca una pulsera con un número de teléfono de contacto.
- Avisar a conocidos de la situación para que alerten a la familia en caso de encontrar al enfermo de alzheimer deambulando.
- Usando un localizador GPS para personas con alzheimer, con el que la familia siempre pueda saber dónde está. Hay localizadores por teleasistencia, en los que el cuidador tiene que llamar a una teleoperadora para saber la posición de la persona que lleva el dispositivo, y localizadores directos, en los que el cuidador tiene un receptor con el que pulsando un botón ve en la pantalla un mapa y la posición exacta de la persona.
Demencia moderada
Conforme la enfermedad avanza los pacientes pueden realizar tareas con cierta independencia (como usar el baño), pero requerirán asistencia en la realización de tareas más complejas (como ir al banco, pagar cuentas, etc.).[82] Paulatinamente llega la pérdida de aptitudes como las de reconocer objetos y personas. Además, pueden manifestarse cambios de conducta como, por ejemplo, arranques violentos incluso en personas que jamás han presentado este tipo de comportamiento.
Los problemas del lenguaje son cada vez más evidentes debido a una inhabilidad para recordar el vocabulario, lo que produce frecuentes sustituciones de palabras erróneas, una condición llamada parafasia. Las capacidades para leer y escribir empeoran progresivamente.[85] [89] Las secuencias motoras complejas se vuelven menos coordinadas, reduciendo la habilidad de la persona de realizar sus actividades rutinarias.[90] Durante esta fase, también empeoran los trastornos de la memoria y el paciente empieza a dejar de reconocer a sus familiares y seres más cercanos.[91] La memoria a largo plazo, que hasta ese momento permanecía intacta, se deteriora.[92]
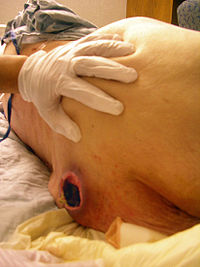 El paciente con Alzheimer no muere por la enfermedad, sino por infecciones secundarias como una llaga de presión o úlcera de decúbito, lesiones que se producen cuando una persona permanece en una sola posición por mucho tiempo.[93]
El paciente con Alzheimer no muere por la enfermedad, sino por infecciones secundarias como una llaga de presión o úlcera de decúbito, lesiones que se producen cuando una persona permanece en una sola posición por mucho tiempo.[93]
En esta etapa se vuelven más notorios los cambios en la conducta. Las manifestaciones neuropsiquiátricas más comunes son las distracciones, el desvarío y los episodios de confusión al final del día (agravados por la fatiga, la poca luz o la oscuridad),[94] así como la irritabilidad y la labilidad emocional, que incluyen llantos o risas inapropiadas, agresión no premeditada e incluso la resistencia a las personas a cargo de sus cuidados. En aproximadamente el 30% de los pacientes aparecen ilusiones en el reconocimiento de personas.[95] [77] También puede aparecer la incontinencia urinaria.[96] Estos síntomas estresan a los familiares y a personas a cargo del cuidado del paciente y pueden verse reducidos si se le traslada a un centro de cuidados a largo plazo.[82] [97]
Demencia avanzada
La enfermedad trae deterioro de masa muscular perdiéndose la movilidad, lo que lleva al enfermo a un estado de encamamiento,[98] la incapacidad de alimentarse a sí mismo,[99] junto a la incontinencia, en aquellos casos que la muerte no haya llegado aún por causas externas (infecciones por úlceras o neumonía, por ejemplo).[100] [101] El lenguaje se torna severamente desorganizado llegándose a perder completamente.[85] A pesar de ello, se conserva la capacidad de recibir y enviar señales emocionales.[102] Los pacientes no podrán realizar ni las tareas más sencillas por sí mismos y requerirán constante supervisión, quedando así completamente dependientes. Puede aún estar presente cierta agresividad, aunque es más frecuente ver extrema apatía y agotamiento.[82]
Diagnóstico
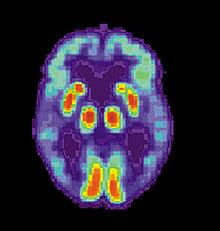 Tomografía del cerebro de un paciente con la EA mostrando pérdida de la función en el lóbulo temporal.
Tomografía del cerebro de un paciente con la EA mostrando pérdida de la función en el lóbulo temporal.
El diagnóstico se basa primero en la historia y la observación clínica, tanto del profesional de la salud como la que es referida por los familiares, basada en las características neurológicas y psicológicas, así como en la ausencia de condiciones alternativas: un diagnóstico de exclusión.[103] [104] Durante una serie de semanas o meses se realizan pruebas de memoria y de funcionamiento o evaluación intelectual.[8] También se realizan análisis de sangre y escáner para descartar diagnósticos alternativos. No existe un test pre mortem para diagnosticar concluyentemente el alzhéimer. Se ha conseguido aproximar la certeza del diagnóstico a un 85%, pero el definitivo debe hacerse con pruebas histológicas sobre tejido cerebral, generalmente obtenidas en la autopsia.[105] Las pruebas de imagen cerebral—Tomografía axial computarizada (TAC), Resonancia magnética nuclear (RMN), tomografía por emisión de positrones (TEP) o la tomografía computarizada por emisión de fotón único—pueden mostrar diferentes signos de que existe una demencia, pero no especifica de cuál se trata.[106] Por tanto, el diagnóstico de la enfermedad de Alzheimer se basa tanto en la presencia de ciertas características neurológicas y neuropsicológicas, como en la ausencia de un diagnóstico alternativo y se apoya en el escáner cerebral para detectar signos de demencia. Actualmente existen en desarrollo nuevas técnicas de diagnóstico basadas en el procesamiento de señales electroencefalográficas.
Una vez identificada, la expectativa promedio de vida de los pacientes que viven con la enfermedad de Alzheimer es aproximadamente de 7 a 10 años, aunque se conocen casos en los que se llega antes a la etapa terminal, entre 4 y 5 años; también existe el otro extremo, donde pueden sobrevivir hasta 21 años.
Criterios de diagnóstico
La Asociación del Alzheimer es el organismo que ha establecido los criterios diagnósticos más comúnmente usados, registrados en los Criterios NINCDS-ADRDA del Alzheimer.[107] Estas pautas requieren que la presencia de un trastorno cognitivo y la sospecha de un síndrome demencial, sean confirmadas con una evaluación neuropsicológica a modo de categorizar el diagnóstico de Alzheimer en dos: posible o probable. La confirmación histológica, que incluye un examen microscópico del tejido cerebral, es requerida para el diagnóstico definitivo del Alzheimer. Estos criterios incluyen que la presencia de un trastorno cognitivo y la sospecha de un síndrome demencial, sean confirmados por evaluaciones neuropsicológicas para distinguir entre un diagnóstico posible o uno probable de la enfermedad de Alzheimer. Se ha mostrado fiabilidad y validez estadística entre los criterios diagnósticos y la confirmación histológica definitiva.[108] Son ocho los dominios cognitivos que con más frecuencia se dañan en la EA: la memoria, el lenguaje, la percepción, la atención, las habilidades constructivas y de orientación, la resolución de problemas y las capacidades funcionales. Estos parámetros son equivalentes a los evaluados en los Criterios NINCDS-ADRDA publicados por la Asociación Americana de Psiquiatría.[109] [110]
Herramientas de diagnóstico
Las evaluaciones neuropsicológicas, incluyendo el examen mini-mental, son ampliamente usadas para evaluar los trastornos cognitivos necesarios para el diagnóstico de la EA. Otra serie de exámenes más comprensivos son necesarios para una mayor fiabilidad en los resultados, especialmente en las fases iniciales de la enfermedad.[111] [112] El examen neurológico en los inicios del Alzheimer es crucial para el diagnóstico diferencial de la EA y otras enfermedades.[8] Las entrevistas a familiares también son usadas para la evaluación de la enfermedad. Los cuidadores pueden proveer información y detalles importantes sobre las habilidades rutinarias, así como la disminución en el tiempo de la función mental del paciente.[113] El punto de vista de la persona a cargo de los cuidados del paciente es de especial importancia debido a que el paciente, por lo general, no está al tanto de sus propias deficiencias.[114] Muchas veces, los familiares tienen desafíos en la detección de los síntomas y signos iniciales de la demencia y puede que no comuniquen la información de manera acertada al profesional de salud especializado.[115]
Los exámenes adicionales pueden proporcionar información de algunos elementos de la enfermedad y tienden a ser usados para descartar otros diagnósticos. Los exámenes de sangre pueden identificar otras causas de demencia que no sea la EA,[8] que pueden ser, en pocos casos, enfermedades reversibles.[116] El examen psicológico para la depresión es de valor, puesto que la depresión puede aparecer de manera concomitante con la EA, o bien ser la causa de los trastornos cognitivos.[117] [118]
En los casos en que estén disponibles imágenes neurológicas especializadas, como la TEP o la tomografía de fotón único, se pueden usar para confirmar el diagnóstico del Alzheimer junto con las evaluaciones del estatus mental del individuo.[119] La capacidad de una tomografía computarizada por emisión de fotón único para distinguir entre la EA y otras posibles causas en alguien que ya fue diagnosticado de demencia, parece ser superior que los intentos de diagnóstico por exámenes mentales y que la historia del paciente.[120] Una nueva técnica, conocida como PiB PET se ha desarrollado para tomar imágenes directamente y de forma clara, de los depósitos beta-amiloides in vivo, con el uso de un radiofármaco que se une selectivamente a los depósitos Aβ.[121] Otro marcado objetivo reciente de la enfermedad de Alzheimer es el análisis del líquido cefalorraquídeo en busca de amiloides beta o proteínas tau.[122] Ambos avances de la imagen médica han producido propuestas para cambios en los criterios diagnósticos.[107] [8]
Tratamiento
Actualmente se está probando una nueva vacuna preventiva contra el alzheimer. El neurólogo Gurutz Linazasoro es el encargado de la misma y afirma que "La valoración no puede ser más positiva. Por fin tenemos algo que abre una ventana a la esperanza" (refiriendose a la vacuna). Su objetivo, según ha dado a conocer el científico, es detener la principal lesión cerebral vinculada al Alzheimer: la producción de placas amoldes. La vacuna produciría anticuerpos encargados de eliminar el beta amiloide 40 y 42, que son las causantes de la neurodegeneración cerebral. Los ensayos de la vacuna se realizarán en Austria, donde 48 pacientes la probarán en las instalaciones de una empresa local experta en monitorización de ensayos. De acreditarse su inocuidad, la vacuna no estará en el mercado hasta dentro de seis o siete años. Tiempo que Linazasoro considera lógico y necesario. Como aún no está en vigencia en el mercado mundial y, no es del todo seguro, hay tratamientos que intentan reducir el grado de progresión de la enfermedad y sus síntomas, de modo que son de naturaleza paliativa. El tratamiento disponible se puede dividir en farmacológico, psicosocial y cuidados.
Retrasar el avance
El avance de la enfermedad puede ser más rápido o más lento en función del entorno de la persona con alzheimer. No es una situación fácil y la familia tendrá que hacer grandes esfuerzos para ofrecerle a la persona con alzheimer un entorno lo más favorable posible.
Aceleradores de la enfermedad
- Estrés familiar
- Cambios bruscos en las rutinas diarias
- Cambio a un domicilio nuevo y desconocido (como son las residencias de mayores)
Retrasadores de la enfermedad
- Ambiente familiar feliz
- Hacer ejercicio
- Socializar con sus amigos u otras personas
Tratamientos farmacológicos
Se ha probado la eficacia de fármacos anticolinesterásicos que tienen una acción inhibidora de la colinesterasa, la enzima encargada de descomponer la acetilcolina (neurotransmisor que falta en la enfermedad de Alzheimer y que incide sustancialmente en la memoria y otras funciones cognitivas). Se han incorporado al tratamiento de la enfermedad nuevos fármacos que intervienen en la regulación de la neurotransmisión glutaminérgica. Con todo esto se ha mejorado el comportamiento del enfermo en cuanto a la apatía, la iniciativa y la capacidad funcional y las alucinaciones, mejorando su calidad de vida. Sin embargo, es preciso remarcar que en la actualidad (2008) la mejoría obtenida con dichos fármacos es discreta, es decir, no se ha conseguido alterar el curso de la demencia subyacente.
El primer fármaco anticolinesterásico comercializado fue la tacrina, hoy no empleada por su hepatotoxicidad. En 2008, en Europa y Norteamérica existen 4 fármacos disponibles, tres de ellos son inhibidores de la acetilcolinesterasa: donepezilo (comercializado como Aricept),[123] rivastigmina (comercializado como Exelon o Prometax)[124] incluyendo el parche de Exelon,[125] y galantamina (comercializado como Reminyl).[126] Los tres presentan un perfil de eficacia similar con parecidos efectos secundarios. Estos últimos suelen ser alteraciones gastrointestinales, anorexia y trastornos del ritmo cardíaco. El cuarto medicamento es un antagonista de los receptores NMDA, la memantina. Ninguno de los cuatro se indica para retardar o detener el progreso de la enfermedad.
La reducción en la actividad de las neuronas colinérgicas es una de las características reconocidas de la enfermedad de Alzheimer.[127] Los inhibidores de la acetilcolinesterasa se emplean para reducir la tasa de degradación de la acetilcolina, manteniendo así concentraciones adecuadas del neurotransmisor en el cerebro y deteniendo su pérdida causada por la muerte de las neuronas colinérgicas.[128] Existen evidencias de que estos medicamentos tienen eficacia en los estadios leves y moderados de la enfermedad,[129] aunque un poco menos de que sean útiles en la fase avanzada. Sólo el donepezilo se ha aprobado para este estado de la demencia.[130] El uso de estos fármacos en los trastornos cognitivos leves no ha mostrado ser capaz de retardar la aparición de la EA.[131] Los efectos adversos más comunes incluyen náuseas y vómitos, ambos ligados al exceso colinérgico que de ellos deriva. Estos efectos aparecen entre, aproximadamente, un 10 y un 20% de los usuarios y tienen severidad leve a moderada. Los efectos secundarios menos frecuentes incluyen calambres musculares, disminución de la frecuencia cardíaca, disminución del apetito y del peso corporal y un incremento en la producción de jugo gástrico.[132]
La memantina es un fármaco con un mecanismo de acción diferente,[133] que tiene su indicación en fases moderadas y avanzadas de la enfermedad. Su teórico mecanismo de acción se basa en antagonizar los receptores NMDA glutaminérgicos, usado en un principio como un agente anti-gripal.[134] El glutamato es un neurotransmisor excitatorio del sistema nervioso central. Al parecer, un exceso de estimulación glutaminérgica podría producir o inducir una serie de reacciones intraneuronales de carácter tóxico, causando la muerte celular por un proceso llamado excitotoxicidad que consiste en una sobreestimulación de los receptores del glutamato. Esta excitotoxicidad no sólo ocurre en pacientes con Alzheimer, sino también en otras enfermedades neurodegenerativas como la enfermedad de Parkinson y la esclerosis múltiple.[134] Los ensayos clínicos han demostrado una eficacia moderada en estos pacientes y un perfil de efectos secundarios aceptable. En 2005 se aprobó también su indicación en fases moderadas de la enfermedad, pero los efectos en las fases iniciales son aún desconocidos.[135] Los efectos adversos de la memantina son infrecuentes y leves e incluyen alucinaciones, confusión, mareos, dolor de cabeza y fatiga.[136] La combinación de memantina y donepezilo ha mostrado ser estadísticamente significativa pero marginalmente exitosa clínicamente.[137]
Además existen fármacos que mejoran algunos de los síntomas que produce esta enfermedad, entre los que se encuentran ansiolíticos, hipnóticos, neurolépticos y antidepresivos. Los fármacos antipsicóticos se indican para reducir la agresión y la psicosis en pacientes con Alzheimer que tienen problemas de conducta, pero se usan con moderación y no de forma rutinaria por razón de los serios efectos secundarios, incluyendo eventos cerebrovasculares, trastornos extrapiramidales y una reducción cognitiva.[138]
Intervención psicosocial
Existen ciertas evidencias de que la estimulación de las capacidades cognitivas ayuda a ralentizar la pérdida de estas funciones y habilidades. Esta estimulación consiste en trabajar aquellas áreas que aún conserva el paciente, de forma que el entrenamiento permita compensar las pérdidas que el paciente está sufriendo con la enfermedad.
Las intervenciones psicosociales se usan conjuntamente con el tratamiento farmacológico y se clasifican en abordajes orientados al comportamiento, las emociones, lo cognitivo y la estimulación. Las investigaciones sobre la efectividad de estas intervenciones aún no se encuentran disponibles y, de hecho, rara vez son específicas a la EA, enfocándose en la demencia en general.[139]
Las intervenciones en el área del comportamiento intentan identificar y reducir los antecedentes y consecuencias de los problemas de conducta. Este abordaje no ha mostrado éxito en mejorar el funcionamiento general del paciente, en especial en relación con su entorno,[140] pero ha podido ayudar a reducir ciertos problemas específicos de comportamiento, como la incontinencia urinaria.[141] Existe aún una falta de datos de calidad sobre la efectividad de estas técnicas en otros problemas como las deambulaciones del paciente.[142] [143]
Las intervenciones orientadas a las emociones incluyen la terapia de validación, la terapia de reminiscencia, la psicoterapia de apoyo, la integración sensorial (también denominada snoezelen) y la terapia de presencia estimuladora. La psicoterapia de apoyo ha tenido poco estudio científico formal, pero algunos especialistas le encuentran utilidad en pacientes con trastornos leves.[139] La terapia de reminiscencia incluye la discusión de experiencias del pasado de manera individual o en grupo, muchas veces con la ayuda de fotografías, objetos del hogar, música y grabaciones u otras pertenencias del pasado. Igualmente, en esta terapia, no hay muchos estudios de calidad sobre su efectividad, aunque puede resultar beneficiosa para la reestructuración cognitiva y el humor.[144] La terapia con presencias estimuladas se basa en las teorías de la adherencia e implica escuchar voces grabadas de los familiares y seres más cercanos del paciente con Alzheimer. Las evidencias preliminares indican que dichas actividades reducen la ansiedad y los comportamientos desafiantes.[145] [146]
Finalmente, la terapia de validación se basa en la aceptación de la realidad y la experiencia personal de otras personas, mientras que la integración sensorial se basa en ejercicios guiados que estimulan los sentidos. Aún no hay suficientes evidencias que apoyen el uso de estas terapias en pacientes con Alzheimer.[147] [148]
La finalidad de las terapias cognitivo-conductuales, que incluyen la orientación y la rehabilitación cognitiva, es reducir las distorsiones cognitivas. La orientación hacia la realidad consiste en la presentación de información acerca de la época, el lugar o la persona con el fin de aliviar su entendimiento acerca de sus alrededores y el lugar que ellos desempeñan en dichos sitios. Por el otro lado, el entrenamiento cognitivo intenta mejorar las capacidades debilitadas al ejercitar las habilidades mentales del paciente. Ambos ejercicios han mostrado cierta efectividad en el mejoramiento de las capacidades cognitivas.[149] [150] Sin embargo, en algunos estudios, estos efectos fueron transitorios y en otros tenían un efecto negativo, pues añadían frustración al paciente, según los reportes.[139]
Los tratamientos orientados a la estimulación incluyen la arteterapia, la musicoterapia y las terapias asistidas por mascotas, el ejercicio físico y cualquier actividad recreacional. La estimulación tiene apoyo modesto al ser aplicado con la intención de mejorar la conducta, el humor y, en menor grado, el funcionamiento del paciente. Sin embargo, si bien son efectos importantes, el principal beneficio reportado entre las terapias de estimulación es el mejoramiento en las rutinas de la vida diaria del paciente.[139]
Cuidados
Debido a que el Alzheimer no tiene cura, con el tiempo el paciente cae en un estado de imposibilidad de autosuficiencia para cuidar de sí mismo, por lo que los cuidados por terceros son una medida vital para esa deficiencia y deben ser abordados cuidadosamente durante el curso de la enfermedad.
En las fases tempranas y moderadas, las modificaciones al ambiente donde vive el paciente y a su estilo de vida, pueden darle seguridad y reducirle las cargas al cuidador.[151] [152] Algunos ejemplos de dichas modificaciones son la adherencia a rutinas simplificadas, como son la colocación de candados, el uso de una pulsera con el número de teléfono del cuidador (o soluciones más avanzadas como un localizador por GPS), el etiquetado de los objetos del hogar y el uso de utensilios modificados para la vida diaria.[153] [154] [139] Puede llegar el punto en que el paciente no sea capaz de alimentarse a sí mismo, de modo que debe empezar a ingerir sus alimentos en porciones más pequeñas o en dietas no sólidas con la ayuda de otras personas.[155] Cuando aparezca una dificultad para tragar, puede que sea indicado el uso de sondas gástricas. En tales casos, la efectividad médica y ética de tener que continuar alimentando al paciente son consideraciones importantes que deben tomar los cuidadores y los familiares del individuo.[156] [157] El uso de restricciones físicas rara vez se indica en cualquier fase de la enfermedad, aunque hay situaciones en que son necesarias para prevenir que el paciente con Alzheimer se dañe a sí mismo o a terceros.[139]
A medida que progresa la enfermedad, pueden aparecer distintas manifestaciones médicas, como las enfermedades orales y dentales, úlceras de presión, desnutrición, problemas de higiene o infecciones respiratorias, urinarias, de la piel o los ojos, entre otras. El manejo cuidado del paciente puede prevenir dichos problemas, pero de llegar a aparecer, deben ser tratados bajo supervisión médica.[158] [101] Durante las etapas finales de la enfermedad, el tratamiento se centra en mantener la calidad de vida hasta el fallecimiento.[159]
Otros tratamientos que se están investigando
Se están realizando experimentos con vacunas. Están basados en la idea de que si el sistema inmune puede ser entrenado para reconocer y atacar la placa beta-amiloide, podría revertirse la deposición de amiloide y parar la enfermedad. Los resultados iniciales en animales fueron prometedores. Sin embargo, cuando las primeras vacunas se probaron en seres humanos en 2002, se produjo inflamación cerebral, concretamente meningoencefalitis, en una pequeña proporción de los participantes en el estudio, por lo que se detuvieron las pruebas. Se continuó estudiando a los participantes y se observó una mejora en lo que respecta a la lentitud del progreso de la enfermedad. Recientemente se ha descubierto que la inflamación cerebral estaba producida por una serie de péptidos que se incluían con la vacuna AN-179, por lo que se está investigando en la creación de una vacuna que no tenga dichos péptidos en su composición.
De estar esta enfermedad relacionada con la resistencia a la insulina, se presentan múltiples alternativas terapéuticas. Se está evaluando actualmente el uso de medicamentos empleados en el tratamiento de la diabetes. Estudios recientes muestran que la administración de insulina por vía intranasal mejora la función cognitiva de pacientes normales y con alzheimer. Una revisión sistemática de los ensayos clínicos hasta ahora desarrollados muestra resultados esperanzadores. Por otra parte, se ha propuesto el empleo de técnicas de inducción enzimática, con enzimas activas por la insulina.
En el campo de la prevención y educación en salud, un estilo de vida saludable, la práctica regular de algún tipo de actividad física y una dieta equilibrada, podrían prevenir la aparición de muchos casos de la enfermedad.
Otra de las áreas de investigación es la medicina regenerativa. Se trata de inyectar en el cerebro del paciente células madre embrionarias o adultas para intentar detener el deterioro cognitivo. Ya se han hecho experimentos en humanos con resultados positivos.
Prevención
 Ciertas actividades intelectuales, tales como el jugar ajedrez, así como las interacciones sociales regulares, han sido asociadas en estudios epidemiológicos con un reducido riesgo de contraer la enfermedad de Alzheimer. Sin embargo, no se ha encontrado aún una relación causal.
Ciertas actividades intelectuales, tales como el jugar ajedrez, así como las interacciones sociales regulares, han sido asociadas en estudios epidemiológicos con un reducido riesgo de contraer la enfermedad de Alzheimer. Sin embargo, no se ha encontrado aún una relación causal.
Los estudios globales sobre las diferentes medidas que se pueden tomar para prevenir o retardar la aparición de la enfermedad de Alzheimer han tenido resultados contradictorios y no se ha comprobado aún una relación causal entre los factores de riesgo y la enfermedad, ni se han atribuido a efectos secundarios específicos. Por el momento, no parece haber medidas definitivas para prevenir la aparición del Alzheimer.[160]
Varios estudios epidemiológicos han propuesto diversas relaciones entre ciertos factores modificables, tales como la dieta, los riesgos cardiovasculares, productos farmacéuticos o las actividades intelectuales entre otros, y la probabilidad de que en una población aparezca la EA. Por ahora se necesitan más investigaciones y ensayos clínicos para comprobar si estos factores ayudan a prevenirla.[161]
Los componentes de una dieta mediterránea, que incluyen frutas y vegetales, pan, cebada y otros cereales, aceite de oliva, pescados y vino tinto, pueden de manera individual o colectiva, reducir el riesgo y el curso de la enfermedad de Alzheimer.[162] Varias vitaminas, tales como la vitamina B12, B3, C o el ácido fólico parecen estar relacionadas con una reducción del riesgo de la EA.[163] Sin embargo, otros estudios han indicado que no tienen un efecto significativo en el desarrollo o el curso de la enfermedad, además de que pueden tener efectos secundarios importantes.[164] La curcumina del curry ha mostrado cierta eficacia en la prevención de daño cerebral en modelos de ratón.[165]
A pesar de que los riesgos cardiovasculares, como la hipercolesterolemia, hipertensión arterial, la diabetes y el tabaquismo, están asociados a un mayor riesgo de desarrollo y progresión de la EA,[166] [167] las estatinas, que son medicamentos que disminuyen la concentración de colesterol en el plasma sanguíneo, no han sido efectivas en la prevención o mejoramiento de la EA.[168] [169] Sin embargo, en algunos individuos, el uso a largo plazo de los antiinflamatorios no esteroideos (AINEs), está vinculado con una reducción de la probabilidad de padecerla.[170] Otros fármacos y terapias, como el reemplazo de hormonas en las mujeres, han dejado de ser aconsejadas como medidas preventivas del Alzheimer.[171] [172] Se incluye también un reporte en 2007 que concluyó la falta de evidencias significativas y la presencia de inconsistencias en el uso de ginkgo biloba para mejorar los trastornos cognitivos.[173]
Hay diferentes actividades intelectuales, como el jugar ajedrez, la lectura, el completar crucigramas o las interacciones sociales frecuentes, que parecen retardar la aparición y reducir la gravedad del Alzheimer.[174] [175] El hablar varios idiomas también parece estar vinculado a la aparición tardía de la enfermedad.[176]
Otros estudios han demostrado que hay un aumento en el riesgo de la aparición del Alzheimer con la exposición a campos magnéticos,[177] [178] la ingestión de metales, en particular de aluminio,[179] [180] o la exposición a ciertos solventes.[181] La calidad de algunos de estos estudios ha sido criticada,[182] y otros estudios han concluido que no hay una relación entre estos factores ambientales y la aparición del Alzheimer.[183] [184] [185] [186]
Véase también
- Demencia de cuerpos de Lewy
- Demencia senil
- Enfermedad de Creutzfeldt-Jakob
- Memoria humana
- Deterioro Cognitivo Leve
- Neuropsicología
- Enfermedades degenerativas
- Diagnóstico por imagen
Referencias
- ↑ Según indican las Academias del español, «aunque la pronunciación etimológica del apellido alemán es [álts-haimer] (en AFI ˈʔalts hai mɐ), en español se pronuncia normalmente como se escribe: [alséimer, alzéimer]». DPD (2005), Entrada de alzheimer
- ↑ Se ha reportado que, por término medio, la enfermedad de Alzheimer tiene una sobrevida después del diagnóstico entre:
- 10 años: MUNOZ CHACON, Yalile. Demencia, el reto del presente siglo (artículo completo disponible en español). Acta méd. costarric. [online]. jun. 2003, vol.45, no.2 [Consultado el 2 de enero de 2010], p.42-42. ISSN 0001-6002.
- 8-10 años: La enfermedad de Alzheimer en el año 2000 (artículo completo disponible en español). Rev Panam Salud Publica [online]. 2001, vol.10, n.4 [Consultado el 3 de enero de 2010], pp. 268-276. ISSN 1020-4989. doi: 10.1590/S1020-49892001001000012.
- 7-9 años: DONOSO S, Archibaldo y BEHRENS P, María Isabel. Variabilidad y variantes de la enfermedad de Alzheimer (artículo completo disponible en español). Rev. méd. Chile [online]. 2005, vol.133, n.4 [Consultado el 2 de enero de 2010], pp. 477-482. ISSN 0034-9887. doi: 10.4067/S0034-98872005000400013.
- 7-8 años: DONOSO S, Archibaldo. La enfermedad de Alzheimer (artículo completo disponible en español). Rev. chil. neuro-psiquiatr. v.41 supl.2 Santiago nov. 2003. Último acceso 2 de enero de 2010. ISSN 0717-9227. doi: 10.4067/S0717-92272003041200003
- ↑ Brookmeyer R., Gray S., Kawas C. (September 1998). «Projections of Alzheimer's disease in the United States and the public health impact of delaying disease onset». American Journal of Public Health 88 (9): pp. 1337–42. doi:. PMID 9736873.
- ↑ E. Kraepelin. Psychiatrie: Ein Lehrbuch für Studierende und Ärzte. II. Band (Barth Verlag, Leipzig, 1910)
- ↑ A. Alzheimer. Allg. Z. Psychiatr. 64,146 (1907)
- ↑ A. Alzheimer. Z. Ges. Neurol. Psychiat. 4, 356 (1911)
- ↑ a b c Berchtold NC, Cotman CW (1998). «Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s». Neurobiol. Aging 19 (3): pp. 173–89. doi:. PMID 9661992.
- ↑ a b c d e f g Waldemar G, Dubois B, Emre M, et al. (January 2007). «Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline». Eur J Neurol 14 (1): pp. e1–26. doi:. PMID 17222085.
- ↑ «Alzheimer's diagnosis of AD». Alzheimer's Research Trust. Consultado el 29-02-2008.
- ↑ Tabert MH, Liu X, Doty RL, Serby M, Zamora D, Pelton GH, Marder K, Albers MW, Stern Y, Devanand DP (2005). «A 10-item smell identification scale related to risk for Alzheimer's disease». Ann. Neurol. 58 (1): pp. 155–160. doi:. PMID 15984022.
- ↑ «Understanding stages and symptoms of Alzheimer's disease». National Institute on Aging (26-10-2007). Consultado el 21-02-2008.
- ↑ Mölsä PK, Marttila RJ, Rinne UK (August 1986). «Survival and cause of death in Alzheimer's disease and multi-infarct dementia». Acta Neurol Scand 74 (2): pp. 103–7. doi:. PMID 3776457.
- ↑ Mölsä PK, Marttila RJ, Rinne UK (March 1995). «Long-term survival and predictors of mortality in Alzheimer's disease and multi-infarct dementia». ActaNeurol Scand 91 (3): pp. 159–64. PMID 7793228.
- ↑ a b Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (June 2004). «The importance of neuritic plaques and tangles to the development and evolution of AD». Neurology 62 (11): pp. 1984–9. PMID 15184601.
- ↑ «Alzheimer's Disease Clinical Trials». US National Institutes of Health. Consultado el 18-08-2008.
- ↑ «Can Alzheimer's disease be prevented» (pdf). National Institute on Aging (29-08-2006). Consultado el 29-02-2008.
- ↑ «The MetLife study of Alzheimer's disease: The caregiving experience» (PDF). MetLife Mature Market Institute (August de 2006). Archivado desde el [{{{url}}} original], el 2008-06-25. Consultado el 12-02-2008.
- ↑ Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J (2007). «Systematic review of information and support interventions for caregivers of people with dementia». BMC Geriatr 7: p. 18. doi:. PMID 17662119.
- ↑ Schneider J, Murray J, Banerjee S, Mann A (August 1999). «EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: I—Factors associated with carer burden». International Journal of Geriatric Psychiatry 14 (8): pp. 651–661. doi:. PMID 10489656.
- ↑ Murray J, Schneider J, Banerjee S, Mann A (August 1999). «EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: II—A qualitative analysis of the experience of caregiving». International Journal of Geriatric Psychiatry 14 (8): pp. 662–667. doi:. PMID 10489657.
- ↑ Auguste D.:
- Alzheimer Alois (1907). «Über eine eigenartige Erikrankung der Hirnrinde [About a peculiar disease of the cerebral cortex]» (en (en alemán)). Allgemeine Zeitschrift fur Psychiatrie und Psychisch-Gerichtlich Medizin 64 (1–2): pp. 146–148.
- Alzheimer Alois (1987). «About a peculiar disease of the cerebral cortex. By Alois Alzheimer, 1907 (Translated by L. Jarvik and H. Greenson)». Alzheimer Dis Assoc Disord 1 (1): pp. 3–8. PMID 3331112.
- Maurer Ulrike, Maurer Konrad (2003). Alzheimer: the life of a physician and the career of a disease. New York: Columbia University Press. p. 270. ISBN 0-231-11896-1.
- ↑ Berrios G E (1990). «Alzheimer's disease: a conceptual history». Int. J. Ger. Psychiatry 5: pp. 355–365. doi:.
- ↑ Kraepelin Emil, Diefendorf A. Ross (translated by) (17-01-2007). Clinical Psychiatry: A Textbook For Students And Physicians (Reprint). Kessinger Publishing. p. 568. ISBN 1-4325-0833-4.
- ↑ Katzman Robert, Terry Robert D, Bick Katherine L (editors) (1978). Alzheimer's disease: senile dementia and related disorders. New York: Raven Press. p. 595. ISBN 0-89004-225-X.
- ↑ Boller F, Forbes MM (June 1998). «History of dementia and dementia in history: an overview». J. Neurol. Sci. 158 (2): pp. 125–33. doi:. PMID 9702682.
- ↑ giancarlo LA, Rocca WA, Schoenberg BS (september 1986). «Origin of the distinction between Alzheimer's disease and senile dementia: how history can clarify nosology». Neurology 62 (41): pp. 1497–9. PMID 3531918.
- ↑ a b Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (January 2008). «Incidence and subtypes of dementia in three elderly populations of central Spain». J. Neurol. Sci. 264 (1-2): pp. 63–72. doi:. PMID 17727890.
- ↑ a b Di Carlo A, Baldereschi M, Amaducci L, et al (January 2002). «Incidence of dementia, Alzheimer's disease, and vascular dementia in Italy. The ILSA Study». J Am Geriatr Soc 50 (1): pp. 41–8. PMID 12028245.
- ↑ Andersen K, Launer LJ, Dewey ME, et al (December 1999). «Gender differences in the incidence of AD and vascular dementia: The EURODEM Studies. EURODEM Incidence Research Group». Neurology 53 (9): pp. 1992–7. PMID 10599770.
- ↑ Estimaciones para 2000 U.S.A.:
- Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA (August 2003). «Alzheimer disease in the US population: prevalence estimates using the 2000 census». Arch. Neurol. 60 (8): pp. 1119–22. doi:. PMID 12925369.
- «Profiles of general demographic characteristics, 2000 census of population and housing, United States» (PDF). U.S. Census Bureau (2001). Consultado el 27-08-2008.
- ↑ a b Ferri, CP,; Prince, M.; Brayne, C.; Brodaty, H.; Fratiglioni, L.; Ganguli, M.; Hall, K.; Hasegawa, K. et ál. (December 2005). «Global prevalence of dementia: a Delphi consensus study» (PDF). The Lancet 366 (9503): pp. 2112–7. doi:. PMID 16360788. http://www.sbgg.org.br/profissional/artigos/pdf/demencia_mundo.pdf.
- ↑ World Health Organization (2006). Neurological Disorders: Public Health Challenges. Switzerland: World Health Organization. pp. 204–207. ISBN 978-92-4-156336-9. http://www.who.int/mental_health/neurology/neurodiso/en/index.html.
- ↑ Alzheimer's Disease International (2010). World Alzheimer Report 2010: The Global Economic Impact of Dementia. Ireland: Alzheimer's Disease International. pp. 56. http://www.alz.org/documents/national/World_Alzheimer_Report_2010.pdf.
- ↑ 2006 prevalence estimate:
- Brookmeyer R, Johnson E, Ziegler-Graham K, MH Arrighi (July 2007). «Forecasting the global burden of Alzheimer’s disease». Alzheimer's and Dementia 3 (3): pp. 186–91. doi:. http://works.bepress.com/cgi/viewcontent.cgi?article=1022&context=rbrookmeyer.
- «World population prospects: the 2006 revision, highlights» (PDF). Population Division, Department of Economic and Social Affairs, United Nations (2007). Consultado el 27-08-2008.
- ↑ Shen ZX (2004). «Brain cholinesterases: II. The molecular and cellular basis of Alzheimer's disease». Med. Hypotheses 63 (2): pp. 308–21. doi:. PMID 15236795.
- ↑ a b Wenk GL (2003). «Neuropathologic changes in Alzheimer's disease». J Clin Psychiatry 64 Suppl 9: pp. 7–10. PMID 12934968.
- ↑ Hardy J, Allsop D (October 1991). «Amyloid deposition as the central event in the aetiology of Alzheimer's disease». Trends Pharmacol. Sci. 12 (10): pp. 383–88. PMID 1763432.
- ↑ a b Mudher A, Lovestone S (January 2002). «Alzheimer's disease-do tauists and baptists finally shake hands?». Trends Neurosci. 25 (1): pp. 22–26. PMID 11801334.
- ↑ Nistor M, Don M, Parekh M, et al (October 2007). «Alpha- and beta-secretase activity as a function of age and beta-amyloid in Down syndrome and normal brain». Neurobiol. Aging 28 (10): pp. 1493–1506. doi:. PMID 16904243.
- ↑ Lott IT, Head E (March 2005). «Alzheimer disease and Down syndrome: factors in pathogenesis». Neurobiol. Aging 26 (3): pp. 383–89. doi:. PMID 15639317.
- ↑ Polvikoski T, Sulkava R, Haltia M, et al (November 1995). «Apolipoprotein E, dementia, and cortical deposition of beta-amyloid protein». N. Engl. J. Med. 333 (19): pp. 1242–47. PMID 7566000.
- ↑ Ratones trasgénicos:
- Games D, Adams D, Alessandrini R, et al (February 1995). «Alzheimer-type neuropathology in transgenic mice overexpressing V717F beta-amyloid precursor protein». Nature 373 (6514): pp. 523–27. doi:. PMID 7845465.
- Masliah E, Sisk A, Mallory M, Mucke L, Schenk D, Games D (September 1996). «Comparison of neurodegenerative pathology in transgenic mice overexpressing V717F beta-amyloid precursor protein and Alzheimer's disease». J. Neurosci. 16 (18): pp. 5795–811. PMID 8795633.
- Hsiao K, Chapman P, Nilsen S, et al (October 1996). «Correlative memory deficits, Abeta elevation, and amyloid plaques in transgenic mice». Science (journal) 274 (5284): pp. 99–102. PMID 8810256.
- ↑ Holmes C, Boche D, Wilkinson D, et al (July 2008). «Long-term effects of Abeta42 immunisation in Alzheimer's disease: follow-up of a randomised, placebo-controlled phase I trial». Lancet 372 (9634): pp. 216–23. doi:. PMID 18640458.
- ↑ Schmitz C, Rutten BP, Pielen A, et al (April 2004). «Hippocampal neuron loss exceeds amyloid plaque load in a transgenic mouse model of Alzheimer's disease». Am. J. Pathol. 164 (4): pp. 1495–1502. PMID 15039236.
- ↑ Goedert M, Spillantini MG, Crowther RA (July 1991). «Tau proteins and neurofibrillary degeneration». Brain Pathol. 1 (4): pp. 279–86. PMID 1669718.
- ↑ Chun W, Johnson GV (2007). «The role of tau phosphorylation and cleavage in neuronal cell death». Front. Biosci. 12: pp. 733–56. PMID 17127334.
- ↑ Stewart R, Liolitsa D. Type 2 diabetes mellitus, cognitive impairment and dementia. Diabet Med. 1999 Feb;16(2):93-112. PMID: 10229302.
- ↑ Diabetes y Alzheimer:
- Biessels GJ, Kappelle LJ; Utrecht Diabetic Encephalopathy Study Group. [Increased risk of Alzheimer's disease in Type II diabetes: insulin resistance of the brain or insulin-induced amyloid pathology?] (en inglés). Biochem Soc Trans. 2005 Nov;33(Pt 5):1041-4. PMID: 16246041.
- Pasquier F, Boulogne A, Leys D, Fontaine P. Diabetes mellitus and dementia. (en inglés). Diabetes Metab. 2006 Nov;32(5 Pt 1):403-14. PMID: 17110895.
- Reed BR, Mungas DM, Kramer JH, Ellis W, Vinters HV, Zarow C, Jagust WJ, Chui HC. Profiles of neuropsychological impairment in autopsy-defined Alzheimer's disease and cerebrovascular disease. Brain. 2007 Mar;130(Pt 3):731-9. Epub 2007 Jan 31. PMID: 17267522.
- ↑ Jagua A, Avila A. Insulina y enfermedad de Alzheimer: una diabetes tipo 3? Rev Fac Med Univ Nac Colomb 2007; 55(1):6-70
- ↑ Suay Llopis, Loreto; Ballester Díez, Ferran (2002) Revisión de los estudios sobre exposición al aluminio y enfermedad de Alzheimer, en Revista Española de Salud Pública, noviembre-diciembre de 2002, Vol. 76, n.º 6. Ministerio de Sanidad y Consumo, España
- ↑ FERREIRA, Pricilla Costa, PIAI, Kamila de Almeida, TAKAYANAGUI, Angela Maria Magosso et al. Aluminum as a risk factor for Alzheimer's disease. Rev. Latino-Am. Enfermagem [online]. 2008, vol. 16, no. 1 [citado 2008-09-10], pp. 151-157. Disponible en la World Wide Web: [1]. ISSN 0104-1169. doi: 10.1590/S0104-11692008000100023
- ↑ Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH (1994). «Regional distribution of neurofibrillary tangles and senile plaques in the cerebral cortex of elderly patients: a quantitative evaluation of a one-year autopsy population from a geriatric hospital». Cereb. Cortex 4 (2): pp. 138–50. PMID 8038565.
- ↑ Hashimoto M, Rockenstein E, Crews L, Masliah E (2003). «Role of protein aggregation in mitochondrial dysfunction and neurodegeneration in Alzheimer's and Parkinson's diseases». Neuromolecular Med. 4 (1-2): pp. 21–36. doi:. PMID 14528050.
- ↑ Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J (July 2006). «Synapse formation and function is modulated by the amyloid precursor protein». J. Neurosci. 26 (27): pp. 7212–21. doi:. PMID 16822978.
- ↑ Turner PR, O'Connor K, Tate WP, Abraham WC (May 2003). «Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory». Prog. Neurobiol. 70 (1): pp. 1–32. PMID 12927332.
- ↑ Hooper NM (April 2005). «Roles of proteolysis and lipid rafts in the processing of the amyloid precursor protein and prion protein». Biochem. Soc. Trans. 33 (Pt 2): pp. 335–8. doi:. PMID 15787600.
- ↑ Ohnishi S, Takano K (March 2004). «Amyloid fibrils from the viewpoint of protein folding». Cell. Mol. Life Sci. 61 (5): pp. 511–24. doi:. PMID 15004691.
- ↑ Hernández F, Avila J (September 2007). «Tauopathies». Cell. Mol. Life Sci. 64 (17): pp. 2219–33. doi:. PMID 17604998.
- ↑ Van Broeck B, Van Broeckhoven C, Kumar-Singh S (2007). «Current insights into molecular mechanisms of Alzheimer disease and their implications for therapeutic approaches». Neurodegener Dis 4 (5): pp. 349–65. doi:. PMID 17622778.
- ↑ Yankner BA, Duffy LK, Kirschner DA (October 1990). «Neurotrophic and neurotoxic effects of amyloid beta protein: reversal by tachykinin neuropeptides». Science (journal) 250 (4978): pp. 279–82. PMID 2218531.
- ↑ Chen X, Yan SD (December 2006). «Mitochondrial Abeta: a potential cause of metabolic dysfunction in Alzheimer's disease». IUBMB Life 58 (12): pp. 686–94. doi:. PMID 17424907.
- ↑ Greig NH, Mattson MP, Perry T, et al (December 2004). «New therapeutic strategies and drug candidates for neurodegenerative diseases: p53 and TNF-alpha inhibitors,». Ann. N. Y. Acad. Sci. 1035: pp. 290–315. doi:. PMID 15681814.
- ↑ a b c d Waring SC, Rosenberg RN (March 2008). «Genome-wide association studies in Alzheimer disease». Arch. Neurol. 65 (3): pp. 329–34. doi:. PMID 18332245.
- ↑ Hoenicka J (2006 Mar 1-15). «Genes in Alzheimer's disease». Rev Neurol 42 (5): pp. 302–05. PMID 16538594.
- ↑ Campion D, Dumanchin C, Hannequin D, et al (September 1999). «Early-onset autosomal dominant Alzheimer disease: prevalence, genetic heterogeneity, and mutation spectrum». Am. J. Hum. Genet. 65 (3): pp. 664–70. doi:. PMID 10441572.
- ↑ Selkoe DJ (June 1999). «Translating cell biology into therapeutic advances in Alzheimer's disease». Nature 399 (6738 Suppl): pp. A23–31. PMID 10392577.
- ↑ Strittmatter WJ, Saunders AM, Schmechel D, et al (March 1993). «Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease». Proc. Natl. Acad. Sci. USA 90 (5): pp. 1977–81. PMID 8446617.
- ↑ Waring SC, Rosenberg RN (March 2008). «Genome-wide association studies in Alzheimer disease». Arch. Neurol. 65 (3): pp. 329–34. doi:. PMID 18332245.
- ↑ Seripa D, Matera MG, Franceschi M, et al (July 2008). «The RELN locus in Alzheimer's disease». J Alzheimers Dis. 14 (3): pp. 335–44. PMID 18599960.
- ↑ Preclinicos:
- Linn RT, Wolf PA, Bachman DL, et al (May 1995). «The 'preclinical phase' of probable Alzheimer's disease. A 13-year prospective study of the Framingham cohort». Arch. Neurol. 52 (5): pp. 485–90. PMID 7733843.
- Saxton J, Lopez OL, Ratcliff G, et al (December 2004). «Preclinical Alzheimer disease: neuropsychological test performance 1.5 to 8 years prior to onset». Neurology 63 (12): pp. 2341–7. PMID 15623697.
- Twamley EW, Ropacki SA, Bondi MW (September 2006). «Neuropsychological and neuroimaging changes in preclinical Alzheimer's disease». J Int Neuropsychol Soc 12 (5): pp. 707–35. doi:. PMID 16961952.
- ↑ Perneczky R, Pohl C, Sorg C, Hartmann J, Komossa K, Alexopoulos P, Wagenpfeil S, Kurz A (2006). «Complex activities of daily living in mild cognitive impairment: conceptual and diagnostic issues». Age Ageing 35 (3): pp. 240–245. doi:. PMID 16513677.
- ↑ MARTINS, Sergilaine Pereira and DAMASCENO, Benito Pereira. Prospective and retrospective memory in mild Alzheimer's disease. Arq. Neuro-Psiquiatr. [online]. 2008, vol. 66, no. 2b [Consultado el 10 de septiembre de 2008], pp. 318-322. Disponible en la World Wide Web: [2]. ISSN 0004-282X. doi: 10.1590/S0004-282X2008000300006
- ↑ Arnáiz E, Almkvist O (2003). «Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease». Acta Neurol. Scand., Suppl. 179: pp. 34–41. doi:. PMID 12603249.
- ↑ Kazui H, Matsuda A, Hirono N, et al (2005). «Everyday memory impairment of patients with mild cognitive impairment». Dement Geriatr Cogn Disord 19 (5-6): pp. 331–7. doi:. PMID 15785034. http://content.karger.com/produktedb/produkte.asp?typ=fulltext&file=DEM20050195_6331.
- ↑ Rapp MA, Reischies FM (2005). «Attention and executive control predict Alzheimer disease in late life: results from the Berlin Aging Study (BASE)». American Journal of Geriatric Psychiatry 13 (2): pp. 134–141. doi:. PMID 15703322.
- ↑ Spaan PE, Raaijmakers JG, Jonker C (2003). «Alzheimer's disease versus normal ageing: a review of the efficiency of clinical and experimental memory measures». Journal of Clinical Experimental Neuropsychology 25 (2): pp. 216–233. PMID 12754679.
- ↑ a b Craig D, Mirakhur A, Hart DJ, McIlroy SP, Passmore AP (2005). «A cross-sectional study of neuropsychiatric symptoms in 435 patients with Alzheimer's disease». American Journal of Geriatric Psychiatry 13 (6): pp. 460–468. doi:. PMID 15956265.
- ↑ Robert PH, Berr C, Volteau M, Bertogliati C, Benoit M, Sarazin M, Legrain S, Dubois B (2006). «Apathy in patients with mild cognitive impairment and the risk of developing dementia of Alzheimer's disease: a one-year follow-up study». Clin Neurol Neurosurg 108 (8): pp. 733–736. doi:. PMID 16567037.
- ↑ Palmer K, Berger AK, Monastero R, Winblad B, Bäckman L, Fratiglioni L (2007). «Predictors of progression from mild cognitive impairment to Alzheimer disease». Neurology 68 (19): pp. 1596–1602. doi:. PMID 17485646.
- ↑ Small BJ, Gagnon E, Robinson B (April 2007). «Early identification of cognitive deficits: preclinical Alzheimer's disease and mild cognitive impairment». Geriatrics 62 (4): pp. 19–23. PMID 17408315.
- ↑ Petersen RC (February 2007). «The current status of mild cognitive impairment--what do we tell our patients?». Nat Clin Pract Neurol 3 (2): pp. 60–1. doi:. PMID 17279076.
- ↑ a b c d e Förstl H, Kurz A (1999). «Clinical features of Alzheimer's disease». European Archives of Psychiatry and Clinical Neuroscience 249 (6): pp. 288–290. PMID 10653284.
- ↑ Carlesimo GA, Oscar-Berman M (June 1992). «Memory deficits in Alzheimer's patients: a comprehensive review». Neuropsychol Rev 3 (2): pp. 119–69. PMID 1300219.
- ↑ Jelicic M, Bonebakker AE, Bonke B (1995). «Implicit memory performance of patients with Alzheimer's disease: a brief review». International Psychogeriatrics 7 (3): pp. 385–392. doi:. PMID 8821346.
- ↑ a b c Frank EM (September 1994). «Effect of Alzheimer's disease on communication function». J S C Med Assoc 90 (9): pp. 417–23. PMID 7967534.
- ↑ Becker JT, Overman AA (2002). «[The semantic memory deficit in Alzheimer's disease]» (en Spanish; Castilian). Rev Neurol 35 (8): pp. 777–83. PMID 12402233.
- ↑ Hodges JR, Patterson K (April 1995). «Is semantic memory consistently impaired early in the course of Alzheimer's disease? Neuroanatomical and diagnostic implications». Neuropsychologia 33 (4): pp. 441–59. PMID 7617154.
- ↑ Benke T (December 1993). «Two forms of apraxia in Alzheimer's disease». Cortex 29 (4): pp. 715–25. PMID 8124945.
- ↑ Forbes KE, Shanks MF, Venneri A (March 2004). «The evolution of dysgraphia in Alzheimer's disease». Brain Res. Bull. 63 (1): pp. 19–24. doi:. PMID 15121235.
- ↑ Galasko D, Schmitt F, Thomas R, Jin S, Bennett D (2005). «Detailed assessment of activities of daily living in moderate to severe Alzheimer's disease». Journal of the International Neuropsychology Society 11 (4): pp. 446–453. PMID 16209425.
- ↑ Galasko D, Schmitt F, Thomas R, Jin S, Bennett D (July 2005). «Detailed assessment of activities of daily living in moderate to severe Alzheimer's disease». J Int Neuropsychol Soc 11 (4): pp. 446–53. PMID 16209425.
- ↑ Sartori G, Snitz BE, Sorcinelli L, Daum I (September 2004). «Remote memory in advanced Alzheimer's disease». Arch Clin Neuropsychol 19 (6): pp. 779–89. doi:. PMID 15288331.
- ↑ [MedlinePlus] (julio de 2008). «Úlcera de decúbito» (en español). Enciclopedia médica en español. Consultado el 10 de septiembre de 2008.
- ↑ Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A (May 2001). «Sundowning and circadian rhythms in Alzheimer's disease». Am J Psychiatry 158 (5): pp. 704–11. PMID 11329390. http://ajp.psychiatryonline.org/cgi/content/full/158/5/704.
- ↑ Síntomas neuropsiquiátricos:
- Scarmeas N, Brandt J, Blacker D, et al (December 2007). «Disruptive behavior as a predictor in Alzheimer disease». Arch. Neurol. 64 (12): pp. 1755–61. doi:. PMID 18071039.
- Tatsch MF, Bottino CM, Azevedo D, et al (May 2006). «Neuropsychiatric symptoms in Alzheimer disease and cognitively impaired, nondemented elderly from a community-based sample in Brazil: prevalence and relationship with dementia severity». Am J Geriatr Psychiatry 14 (5): pp. 438–45. doi:. PMID 16670248.
- Volicer L, Bass EA, Luther SL (October 2007). «Agitation and resistiveness to care are two separate behavioral syndromes of dementia». J Am Med Dir Assoc 8 (8): pp. 527–32. doi:. PMID 17931577.
- ↑ Honig LS, Mayeux R (June 2001). «Natural history of Alzheimer's disease». Aging (Milano) 13 (3): pp. 171–82. PMID 11442300.
- ↑ Gold DP, Reis MF, Markiewicz D, Andres D (January 1995). «When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia». J Am Geriatr Soc 43 (1): pp. 10–6. PMID 7806732.
- ↑ Souren LE, Franssen EH, Reisberg B (June 1995). «Contractures and loss of function in patients with Alzheimer's disease». J Am Geriatr Soc 43 (6): pp. 650–5. PMID 7775724.
- ↑ Berkhout AM, Cools HJ, van Houwelingen HC (September 1998). «The relationship between difficulties in feeding oneself and loss of weight in nursing-home patients with dementia». Age Ageing 27 (5): pp. 637–41. PMID 12675103.
- ↑ Wada H, Nakajoh K, Satoh-Nakagawa T, et al (2001). «Risk factors of aspiration pneumonia in Alzheimer's disease patients». Gerontology 47 (5): pp. 271–6. PMID 11490146.
- ↑ a b Gambassi G, Landi F, Lapane KL, Sgadari A, Mor V, Bernabei R (July 1999). «Predictors of mortality in patients with Alzheimer's disease living in nursing homes». J. Neurol. Neurosurg. Psychiatr. 67 (1): pp. 59–65. PMID 10369823.
- ↑ Bär M, Kruse A, Re S (December 2003). «[Situations of emotional significance in residents suffering from dementia]» (en German). Z Gerontol Geriatr 36 (6): pp. 454–62. doi:. PMID 14685735.
- ↑ Mendez MF (2006). «The accurate diagnosis of early-onset dementia». International Journal of Psychiatry Medicine 36 (4): pp. 401–412. PMID 17407994.
- ↑ Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J (November 2006). «Therapeutic approaches to Alzheimer's disease». Brain 129 (Pt 11): pp. 2840–55. doi:. PMID 17018549.
- ↑ McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM (July 1984). «Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease». Neurology 34 (7): pp. 939–44. PMID 6610841.
- ↑ «Dementia: Quick reference guide» (PDF). (UK) National Institute for Health and Clinical Excellence (November de 2006). Consultado el 22-02-2008.
- ↑ a b Dubois B, Feldman HH, Jacova C, et al (August 2007). «Research criteria for the diagnosis of Alzheimer's disease: revising the NINCDS-ADRDA criteria». Lancet Neurol 6 (8): pp. 734–46. doi:. PMID 17616482.
- ↑ Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF (December 1994). «Reliability and validity of NINCDS-ADRDA criteria for Alzheimer's disease. The National Institute of Mental Health Genetics Initiative». Arch. Neurol. 51 (12): pp. 1198–204. PMID 7986174.
- ↑ American Psychiatric Association (2000). Diagnostic and Statistical Manual of Mental disorders, 4th Edition Text Revision. Washington DC.
- ↑ Ito N (May 1996). «[Clinical aspects of dementia]» (en Japanese). Hokkaido Igaku Zasshi 71 (3): pp. 315–20. PMID 8752526.
- ↑ Tombaugh TN, McIntyre NJ (September 1992). «The mini-mental state examination: a comprehensive review». J Am Geriatr Soc 40 (9): pp. 922–35. PMID 1512391.
- ↑ Pasquier F (January 1999). «Early diagnosis of dementia: neuropsychology». J. Neurol. 246 (1): pp. 6–15. PMID 9987708.
- ↑ Harvey PD, Moriarty PJ, Kleinman L, et al (2005). «The validation of a caregiver assessment of dementia: the Dementia Severity Scale». Alzheimer Dis Assoc Disord 19 (4): pp. 186–94. PMID 16327345.
- ↑ Antoine C, Antoine P, Guermonprez P, Frigard B (2004). «[Awareness of deficits and anosognosia in Alzheimer's disease.]» (en francés). Encephale 30 (6): pp. 570–7. PMID 15738860.
- ↑ Cruz VT, Pais J, Teixeira A, Nunes B (2004). «[The initial symptoms of Alzheimer disease: caregiver perception]» (en Portuguese). Acta Med Port 17 (6): pp. 435–44. PMID 16197855.
- ↑ Clarfield AM (October 2003). «The decreasing prevalence of reversible dementias: an updated meta-analysis». Arch. Intern. Med. 163 (18): pp. 2219–29. doi:. PMID 14557220.
- ↑ Geldmacher DS, Whitehouse PJ (May 1997). «Differential diagnosis of Alzheimer's disease». Neurology 48 (5 Suppl 6): pp. S2–9. PMID 9153154.
- ↑ Potter GG, Steffens DC (May 2007). «Contribution of depression to cognitive impairment and dementia in older adults». Neurologist 13 (3): pp. 105–17. doi:. PMID 17495754.
- ↑ Bonte FJ, Harris TS, Hynan LS, Bigio EH, White CL (July 2006). «Tc-99m HMPAO SPECT in the differential diagnosis of the dementias with histopathologic confirmation». Clin Nucl Med 31 (7): pp. 376–8. doi:. PMID 16785801.
- ↑ Dougall NJ, Bruggink S, Ebmeier KP (2004). «Systematic review of the diagnostic accuracy of 99mTc-HMPAO-SPECT in dementia». Am J Geriatr Psychiatry 12 (6): pp. 554–70. doi:. PMID 15545324.
- ↑ Sobre el PiB PET:
- Kemppainen NM, Aalto S, Karrasch M, et al (January 2008). «Cognitive reserve hypothesis: Pittsburgh Compound B and fluorodeoxyglucose positron emission tomography in relation to education in mild Alzheimer's disease». Ann. Neurol. 63 (1): pp. 112–8. doi:. PMID 18023012.
- Ikonomovic MD, Klunk WE, Abrahamson EE, et al (June 2008). «Post-mortem correlates of in vivo PiB-PET amyloid imaging in a typical case of Alzheimer's disease». Brain 131 (Pt 6): pp. 1630–45. doi:. PMID 18339640.
- Jack CR, Lowe VJ, Senjem ML, et al (March 2008). «11C PiB and structural MRI provide complementary information in imaging of Alzheimer's disease and amnestic mild cognitive impairment». Brain 131 (Pt 3): pp. 665–80. doi:. PMID 18263627.
- ↑ Marksteiner J, Hinterhuber H, Humpel C (June 2007). «Cerebrospinal fluid biomarkers for diagnosis of Alzheimer's disease: beta-amyloid(1-42), tau, phospho-tau-181 and total protein». Drugs Today 43 (6): pp. 423–31. doi:. PMID 17612711.
- ↑ «Donepezil». US National Library of Medicine (Medline Plus) (08-01-2007). Consultado el 20-03-2008.
- ↑ «Rivastigmine». US National Library of Medicine (Medline Plus) (08-01-2007). Consultado el 20-03-2008.
- ↑ «Rivastigmine Transdermal». US National Library of Medicine (Medline Plus) (08-01-2007). Consultado el 20-03-2008.
- ↑ «Galantamine». US National Library of Medicine (Medline Plus) (08-01-2007). Consultado el 20-03-2008.
- ↑ Geula C, Mesulam MM (1995). «Cholinesterases and the pathology of Alzheimer disease». Alzheimer Dis Assoc Disord 9 Suppl 2: pp. 23–28. PMID 8534419.
- ↑ Stahl SM (2000). «The new cholinesterase inhibitors for Alzheimer's disease, Part 2: illustrating their mechanisms of action». J Clin Psychiatry 61 (11): pp. 813–814. PMID 11105732.
- ↑ Birks J (2006). «Cholinesterase inhibitors for Alzheimer's disease». Cochrane Database Syst Rev (1): pp. CD005593. doi:. PMID 16437532.
- ↑ Birks J, Harvey RJ (2006). «Donepezil for dementia due to Alzheimer's disease». Cochrane Database Syst Rev (1): pp. CD001190. doi:. PMID 16437430.
- ↑ Raschetti R, Albanese E, Vanacore N, Maggini M (2007). «Cholinesterase inhibitors in mild cognitive impairment: a systematic review of randomised trials». PLoS Med 4 (11): pp. e338. doi:. PMID 18044984.
- ↑ Información sobre los inhibidores de la acetilcolinesterasa:
- «Aricept Prescribing information» (PDF). Eisai and Pfizer. Consultado el 18-08-2008.
- «Razadyne ER U.S. Full Prescribing Information» (PDF). Ortho-McNeil Neurologics. Consultado el 19-02-2008.
- «Exelon ER U.S. Prescribing Information» (PDF). Novartis Pharmaceuticals. Consultado el 19-02-2008.
- «Exelon U.S. Prescribing Information» (PDF). Novartis Pharmaceuticals. Consultado el 21-02-2008.
- «Exelon Warning Letter». FDA.
- ↑ «Memantine». US National Library of Medicine (Medline) (04-01-2004). Consultado el 22-03-2008.
- ↑ a b Lipton SA (2006). «Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond». Nat Rev Drug Discov 5 (2): pp. 160–170. doi:. PMID 16424917.
- ↑ Areosa Sastre A, McShane R, Sherriff F (2004). «Memantine for dementia». Cochrane Database Syst Rev (4): pp. CD003154. doi:. PMID 15495043.
- ↑ «Namenda Prescribing Information» (PDF). Forest Pharmaceuticals. Consultado el 19-02-2008.
- ↑ Raina P, Santaguida P, Ismaila A, et al (2008). «Effectiveness of cholinesterase inhibitors and memantine for treating dementia: evidence review for a clinical practice guideline». Annals of Internal Medicine 148 (5): pp. 379–397. PMID 18316756.
- ↑ Uso de antipsicóticos:
- Ballard C, Waite J (2006). «The effectiveness of atypical antipsychotics for the treatment of aggression and psychosis in Alzheimer's disease». Cochrane Database Syst Rev (1): pp. CD003476. doi:. PMID 16437455.
- Ballard C, Lana MM, Theodoulou M, et al (2008). «A Randomised, Blinded, Placebo-Controlled Trial in Dementia Patients Continuing or Stopping Neuroleptics (The DART-AD Trial)». PLoS Med. 5 (4): pp. e76. doi:. PMID 18384230.
- Sink KM, Holden KF, Yaffe K (2005). «Pharmacological treatment of neuropsychiatric symptoms of dementia: a review of the evidence». JAMA 293 (5): pp. 596–608. doi:. PMID 15687315.
- ↑ a b c d e f «Practice Guideline for the Treatment of Patients with Alzheimer's disease and Other Dementias» (PDF). American Psychiatric Association (October de 2007). doi:10.1176/appi.books.9780890423967.152139. Consultado el 28-12-2007.
- ↑ Bottino CM, Carvalho IA, Alvarez AM, et al (2005). «Cognitive rehabilitation combined with drug treatment in Alzheimer's disease patients: a pilot study». Clin Rehabil 19 (8): pp. 861–869. doi:. PMID 16323385.
- ↑ Doody RS, Stevens JC, Beck C, et al (2001). «Practice parameter: management of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology». Neurology 56 (9): pp. 1154–1166. PMID 11342679.
- ↑ Hermans DG, Htay UH, McShane R (2007). «Non-pharmacological interventions for wandering of people with dementia in the domestic setting». Cochrane Database Syst Rev (1): pp. CD005994. doi:. PMID 17253573.
- ↑ Robinson L, Hutchings D, Dickinson HO, et al (2007). «Effectiveness and acceptability of non-pharmacological interventions to reduce wandering in dementia: a systematic review». Int J Geriatr Psychiatry 22 (1): pp. 9–22. doi:. PMID 17096455.
- ↑ Woods B, Spector A, Jones C, Orrell M, Davies S (2005). «Reminiscence therapy for dementia». Cochrane Database Syst Rev (2): pp. CD001120. doi:. PMID 15846613.
- ↑ Peak JS, Cheston RI (2002). «Using simulated presence therapy with people with dementia». Aging Ment Health 6 (1): pp. 77–81. doi:. PMID 11827626.
- ↑ Camberg L, Woods P, Ooi WL, et al (1999). «Evaluation of Simulated Presence: a personalised approach to enhance well-being in persons with Alzheimer's disease». J Am Geriatr Soc 47 (4): pp. 446–452. PMID 10203120.
- ↑ Neal M, Briggs M (2003). «Validation therapy for dementia». Cochrane Database Syst Rev (3): pp. CD001394. doi:. PMID 12917907.
- ↑ Chung JC, Lai CK, Chung PM, French HP (2002). «Snoezelen for dementia». Cochrane Database Syst Rev (4): pp. CD003152. doi:. PMID 12519587.
- ↑ Spector A, Orrell M, Davies S, Woods B (2000). «Withdrawn: Reality orientation for dementia». Cochrane Database Syst Rev (3): pp. CD001119. doi:. PMID 17636652.
- ↑ Spector A, Thorgrimsen L, Woods B, et al (2003). «Efficacy of an evidence-based cognitive stimulation therapy programme for people with dementia: randomised controlled trial». Br J Psychiatry 183: pp. 248–254. doi:. PMID 12948999.
- ↑ Gitlin LN, Corcoran M, Winter L, Boyce A, Hauck WW (February 2001). «A randomized, controlled trial of a home environmental intervention: effect on efficacy and upset in caregivers and on daily function of persons with dementia». Gerontologist 41 (1): pp. 4–14. PMID 11220813. http://gerontologist.gerontologyjournals.org/cgi/pmidlookup?view=long&pmid=11220813.
- ↑ Gitlin LN, Hauck WW, Dennis MP, Winter L (March 2005). «Maintenance of effects of the home environmental skill-building program for family caregivers and individuals with Alzheimer's disease and related disorders». J. Gerontol. A Biol. Sci. Med. Sci. 60 (3): pp. 368–74. PMID 15860476.
- ↑ «Treating behavioral and psychiatric symptoms». Alzheimer's Association (2006). Consultado el 25-09-2006.
- ↑ Dunne TE, Neargarder SA, Cipolloni PB, Cronin-Golomb A (2004). «Visual contrast enhances food and liquid intake in advanced Alzheimer's disease». Clinical Nutrition 23 (4): pp. 533–538. doi:. PMID 15297089.
- ↑ Dudek, Susan G. (2007). Nutrition essentials for nursing practice. Hagerstown, Maryland: Lippincott Williams & Wilkins. pp. 360. ISBN 0-7817-6651-6. http://books.google.com/books?id=01zo6yf0IUEC&pg=PA360&dq=alzheimer%27s+chew&lr=&client=firefox-a&sig=ACfU3U05ChdcpPonim4W-Z1HIJdPQ93l7Q. Consultado el 19-08-2008.
- ↑ Dennehy C (2006). «Analysis of patients' rights: dementia and PEG insertion». Br J Nurs 15 (1): pp. 18–20. PMID 16415742.
- ↑ Chernoff R (April 2006). «Tube feeding patients with dementia». Nutr Clin Pract 21 (2): pp. 142–6. PMID 16556924.
- ↑ Problemas médicos:
- Head B (January 2003). «Palliative care for persons with dementia». Home Healthc Nurse 21 (1): pp. 53–60; quiz 61. PMID 12544465.
- Friedlander AH, Norman DC, Mahler ME, Norman KM, Yagiela JA (September 2006). «Alzheimer's disease: psychopathology, medical management and dental implications». J Am Dent Assoc 137 (9): pp. 1240–51. PMID 16946428.
- Belmin J (2007). «Practical guidelines for the diagnosis and management of weight loss in Alzheimer's disease: a consensus from appropriateness ratings of a large expert panel». J Nutr Health Aging 11 (1): pp. 33–7. PMID 17315078.
- McCurry SM, Gibbons LE, Logsdon RG, Vitiello M, Teri L (October 2003). «Training caregivers to change the sleep hygiene practices of patients with dementia: the NITE-AD project». J Am Geriatr Soc 51 (10): pp. 1455–60. PMID 14511168.
- Perls TT, Herget M (December 1995). «Higher respiratory infection rates on an Alzheimer's special care unit and successful intervention». J Am Geriatr Soc 43 (12): pp. 1341–4. PMID 7490383.
- ↑ Shega JW, Levin A, Hougham GW, et al (April 2003). «Palliative Excellence in Alzheimer Care Efforts (PEACE): a program description». J Palliat Med 6 (2): pp. 315–20. doi:. PMID 12854952.
- ↑ No hay pruebas que recomienden medidas preventivas:
- Kawas CH (2006). «Medications and diet: protective factors for AD?». Alzheimer Dis Assoc Disord 20 (3 Suppl 2): pp. S89–96. PMID 16917203.
- Luchsinger JA, Mayeux R (2004). «Dietary factors and Alzheimer's disease». Lancet Neurol 3 (10): pp. 579–87. doi:. PMID 15380154.
- Luchsinger JA, Noble JM, Scarmeas N (2007). «Diet and Alzheimer's disease». Curr Neurol Neurosci Rep 7 (5): pp. 366–72. doi:. PMID 17764625.
- ↑ Szekely CA, Breitner JC, Zandi PP (2007). «Prevention of Alzheimer's disease». Int Rev Psychiatry 19 (6): pp. 693–706. doi:. PMID 18092245.
- ↑ Dieta mediterranea:
- Scarmeas N, Stern Y, Mayeux R, Luchsinger JA (2006). «Mediterranean diet, Alzheimer disease, and vascular mediation». Arch. Neurol. 63 (12): pp. 1709–1717. doi:. PMID 17030648.
- Scarmeas N, Luchsinger JA, Mayeux R, Stern Y (2007). «Mediterranean diet and Alzheimer disease mortality». Neurology 69 (11): pp. 1084–93. doi:. PMID 17846408.
- Barberger-Gateau P, Raffaitin C, Letenneur L, Berr C, Tzourio C, Dartigues JF, Alpérovitch A (2007). «Dietary patterns and risk of dementia: the Three-City cohort study». Neurology 69 (20): pp. 1921–1930. doi:. PMID 17998483.
- Dai Q, Borenstein AR, Wu Y, Jackson JC, Larson EB (2006). «Fruit and vegetable juices and Alzheimer's disease: the Kame Project». American Journal of Medicine 119 (9): pp. 751–759. doi:. PMID 16945610.
- Savaskan E, Olivieri G, Meier F, Seifritz E, Wirz-Justice A, Müller-Spahn F (2003). «Red wine ingredient resveratrol protects from beta-amyloid neurotoxicity». Gerontology 49 (6): pp. 380–383. doi:. PMID 14624067.
- ↑ Presencia de vitaminas:
- Morris MC, Schneider JA, Tangney CC (2006). «Thoughts on B-vitamins and dementia». J. Alzheimers Dis. 9 (4): pp. 429–33. PMID 16917152.
- Landmark K (2006). «[Could intake of vitamins C and E inhibit development of Alzheimer dementia?]» (en Norwegian). Tidsskr. Nor. Laegeforen. 126 (2): pp. 159–61. PMID 16415937.
- Luchsinger JA, Tang MX, Miller J, Green R, Mayeux R (2007). «Relation of higher folate intake to lower risk of Alzheimer disease in the elderly». Arch. Neurol. 64 (1): pp. 86–92. doi:. PMID 17210813.
- Morris MC, Evans DA, Bienias JL, et al (August 2004). «Dietary niacin and the risk of incident Alzheimer's disease and of cognitive decline». J. Neurol. Neurosurg. Psychiatr. 75 (8): pp. 1093–9. doi:. PMID 15258207.
- ↑ Vitaminas no previenen la enfermedad:
- Morris MC, Evans DA, Schneider JA, Tangney CC, Bienias JL, Aggarwal NT (2006). «Dietary folate and vitamins B-12 and B-6 not associated with incident Alzheimer's disease». J. Alzheimers Dis. 9 (4): pp. 435–43. PMID 16917153.
- Malouf M, Grimley EJ, Areosa SA (2003). «Folic acid with or without vitamin B12 for cognition and dementia». Cochrane Database Syst Rev (4): pp. CD004514. doi:. PMID 14584018.
- Sun Y, Lu CJ, Chien KL, Chen ST, Chen RC (2007). «Efficacy of multivitamin supplementation containing vitamins B6 and B12 and folic acid as adjunctive treatment with a cholinesterase inhibitor in Alzheimer's disease: a 26-week, randomised, double-blind, placebo-controlled study in Taiwanese patients». Clin Ther 29 (10): pp. 2204–14. doi:. PMID 18042476.
- Boothby LA, Doering PL (2005). «Vitamin C and vitamin E for Alzheimer's disease». Ann Pharmacother 39 (12): pp. 2073–80. doi:. PMID 16227450.
- Gray SL, Anderson ML, Crane PK, Breitner JC, McCormick W, Bowen JD, Teri L, Larson E (2008). «Antioxidant vitamin supplement use and risk of dementia or Alzheimer's disease in older adults». J Am Geriatr Soc 56 (2): pp. 291–295. doi:. PMID 18047492.
- ↑ Curcumina en la dieta:
- Garcia-Alloza M, Borrelli LA, Rozkalne A, Hyman BT, Bacskai BJ (2007). «Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model». Journal of Neurochemistry 102 (4): pp. 1095–1104. doi:. PMID 17472706.
- Lim GP, Chu T, Yang F, Beech W, Frautschy SA, Cole GM (2001). «The curry spice curcumin reduces oxidative damage and amyloid pathology in an Alzheimer transgenic mouse». Journal of Neuroscience 21 (21): pp. 8370–8377. PMID 11606625.
- ↑ Rosendorff C, Beeri MS, Silverman JM (2007). «Cardiovascular risk factors for Alzheimer's disease». Am J Geriatr Cardiol 16 (3): pp. 143–9. doi:. PMID 17483665.
- ↑ Gustafson D, Rothenberg E, Blennow K, Steen B, Skoog I (2003). «An 18-year follow-up of overweight and risk of Alzheimer disease». Arch. Intern. Med. 163 (13): pp. 1524–1528. doi:. PMID 12860573.
- ↑ Reiss AB, Wirkowski E (2007). «Role of HMG-CoA reductase inhibitors in neurological disorders : progress to date». Drugs 67 (15): pp. 2111–2120. PMID 17927279.
- ↑ Kuller LH (2007). «Statins and dementia». Current Atherosclerosis Reports 9 (2): pp. 154–161. doi:. PMID 17877925.
- ↑ Szekely CA, Breitner JC, Fitzpatrick AL, Rea TD, Psaty BM, Kuller LH, Zandi PP (2008). «NSAID use and dementia risk in the Cardiovascular Health Study: role of APOE and NSAID type». Neurology 70 (1): pp. 17–24. doi:. PMID 18003940.
- ↑ Craig MC, Murphy DG (2007). «Estrogen: effects on normal brain function and neuropsychiatric disorders». Climacteric 10 Suppl 2: pp. 97–104. doi:. PMID 17882683.
- ↑ Mori K, Takeda M (2007). «Hormone replacement Up-to-date. Hormone replacement therapy and brain function» (en Japanese). Clin Calcium 17 (9): pp. 1349–1354. PMID 17767023.
- ↑ Birks J, Grimley Evans J (2007). «Ginkgo biloba for cognitive impairment and dementia». Cochrane Database Syst Rev (2): pp. CD003120. doi:. PMID 17443523. http://mrw.interscience.wiley.com/cochrane/clsysrev/articles/CD003120/frame.html.
- ↑ Verghese J, Lipton R, Katz M, Hall C, Derby C, Kuslansky G, Ambrose A, Sliwinski M, Buschke H (2003). «Leisure activities and the risk of dementia in the elderly». N Engl J Med 348 (25): pp. 2508–2516. doi:. PMID 12815136.
- ↑ Bennett DA, Schneider JA, Tang Y, Arnold SE, Wilson RS (2006). «The effect of social networks on the relation between Alzheimer's disease pathology and level of cognitive function in old people: a longitudinal cohort study». Lancet Neurol 5 (5): pp. 406–412. doi:. PMID 16632311.
- ↑ Bialystok E, Craik FIM, Freedman M (2007). «Bilingualism as a protection against the onset of symptoms of dementia». Neuropsychologia 42 (2): pp. 459–464. doi:.
- ↑ Davanipour Z, Tseng CC, Lee PJ, Sobel E (2007). «A case-control study of occupational magnetic field exposure and Alzheimer's disease: results from the California Alzheimer's Disease Diagnosis and Treatment Centers». BMC Neurol 7: pp. 13. doi:. PMID 17559686.
- ↑ Qiu C, Fratiglioni L, Karp A, Winblad B, Bellander T (2004). «Occupational exposure to electromagnetic fields and risk of Alzheimer's disease». Epidemiology 15 (6): pp. 687–694. doi:. PMID 15475717.
- ↑ Shcherbatykh I, Carpenter DO (May 2007). «The role of metals in the etiology of Alzheimer's disease». J. Alzheimers Dis. 11 (2): pp. 191–205. PMID 17522444.
- ↑ Rondeau V, Commenges D, Jacqmin-Gadda H, Dartigues JF (July 2000). «Relation between aluminum concentrations in drinking water and Alzheimer's disease: an 8-year follow-up study». Am. J. Epidemiol. 152 (1): pp. 59–66. PMID 10901330.
- ↑ Kukull WA, Larson EB, Bowen JD, et al (June 1995). «Solvent exposure as a risk factor for Alzheimer's disease: a case-control study». Am. J. Epidemiol. 141 (11): pp. 1059–71; discussion 1072–9. PMID 7771442.
- ↑ Santibáñez M, Bolumar F, García AM (2007). «Occupational risk factors in Alzheimer's disease: a review assessing the quality of published epidemiological studies». Occupational and Environmental Medicine 64 (11): pp. 723–732. doi:. PMID 17525096.
- ↑ Seidler A, Geller P, Nienhaus A, Bernhardt T, Ruppe I, Eggert S, Hietanen M, Kauppinen T, Frölich L (2007). «Occupational exposure to low frequency magnetic fields and dementia: a case-control study». Occup Environ Med 64 (2): pp. 108–114. doi:. PMID 17043077.
- ↑ Rondeau V (2002). «A review of epidemiologic studies on aluminum and silica in relation to Alzheimer's disease and associated disorders». Rev Environ Health 17 (2): pp. 107–21. PMID 12222737.
- ↑ Martyn CN, Coggon DN, Inskip H, Lacey RF, Young WF (May 1997). «Aluminum concentrations in drinking water and risk of Alzheimer's disease». Epidemiology 8 (3): pp. 281–6. PMID 9115023.
- ↑ Graves AB, Rosner D, Echeverria D, Mortimer JA, Larson EB (September 1998). «Occupational exposures to solvents and aluminium and estimated risk of Alzheimer's disease». Occup Environ Med 55 (9): pp. 627–33. PMID 9861186.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Enfermedad de Alzheimer. Commons
Wikimedia Commons alberga contenido multimedia sobre Enfermedad de Alzheimer. Commons- Alzheimer Internacional 2011: 2011 Año de la investigación en Alzheimer
- INECO: Información para familiares y cuidadores de personas con Alzheimer u otras demencias
- Talleres de la Fundación INECO, para familiares de personas con Alzheimer en Argentina
- Alzheimer Online - Fundación Al-Andalus (Primer Portal de habla hispana)
- Fundación Alzheimer España
- Alzheimer´s Disease Internacional (inglés)
- Alzheimer Europe: portal de la UE (varios idiomas)
- Alzheimer- Causas, Síntomas,Prevención
- Alzheimer´s Association (inglés y recursos en español)
- Fundación Alzheimer "Alguien Con Quien Contar" I.A.P. México
- MedlinePlus Enciclopedia 000760
- Info-Alzheimer.com Web para familiares y cuidadores de pacientes con Enfermedad de Alzheimer
- Alzheimer Universal
- Fundación Reina Sofía Proyecto Alzheimer
- Alzheimer Venezuela Cuidamos con Amor
- En MedlinePlus puede encontrar más información sobre Enfermedad de Alzheimer
- Un vídeo educativo sobre el estudio del Alzheimer (subtítulos en español)
- Información sobre el Alzheimer (español)
Categorías:- Enfermedad de Alzheimer
- Enfermedades epónimas
- Enfermedades metabólicas
- Memoria
Wikimedia foundation. 2010.