- Masa atómica
-
La masa atómica (ma) es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada.[1] La masa atómica puede ser considerada como la masa total de protones y neutrones en un solo átomo (cuando el átomo no tiene movimiento). La masa atómica es algunas veces usada incorrectamente como un sinónimo de masa atómica relativa, masa atómica media y peso atómico; estos últimos difieren sutilmente de la masa atómica. La masa atómica está definida como la masa de un átomo, que sólo puede ser de un isótopo a la vez, y no es un promedio ponderado en las abundancias de los isótopos. En el caso de muchos elementos que tienen un isótopo dominante, la similitud/diferencia numérica real entre la masa atómica del isótopo más común y la masa atómica relativa o peso atómico estándar puede ser muy pequeña, tal que no afecta muchos cálculos bastos, pero tal error puede ser crítico cuando se consideran átomos individuales. Para elementos con más de un isótopo común, la diferencia puede llegar a ser de media unidad o más (por ejemplo, cloro). La masa atómica de un isótopo raro puede diferir de la masa atómica relativa o peso atómico estándar en varias unidades de masa.
El peso atómico estándar se refiere a la media de las masas atómicas relativas de un elemento en el medio local de la corteza terrestre y la atmósfera terrestre, como está determinado por la Commission on Atomic Weights and Isotopic Abundances (Comisión de Pesos Atómicos y Abundancias Isotópicas) de la IUPAC.[2] Estos valores son los que están incluidos en una tabla periódica estándar, y es lo que es más usado para los cálculos ordinarios. Se incluye una incertidumbre en paréntesis que frecuentemente refleja la variabilidad natural en la distribución isotópica, en vez de la incertidumbre en la medida.[3] Para los elementos sintéticos, el isótopo formado depende de los medios de síntesis, por lo que el concepto de abundancia isotópica natural no tiene sentido. En consecuencia, para elementos sintéticos, el conteo total de nucleones del isótopo más estable (esto es, el isótopo con la vida media más larga) está listado en paréntesis en el lugar del peso atómico estándar. El litio representa un caso único, donde la abundancia natural de los isótopos ha sido perturbada por las actividades humanas al punto de afectar la incertidumbre en su peso atómico estándar, incluso en muestras obtenidas de fuentes naturales, como los ríos.
La masa atómica relativa es un sinónimo para peso atómico y está cercanamente relacionado a masa atómica promedio (pero no es un sinónimo de masa atómica), la media ponderada de las masas atómicas de todos los átomos de un elemento químico encontrados en una muestra particular, ponderados por abundancia isotópica.[4] Esto es usado frecuentemente como sinónimo para peso atómico relativo, y no es incorrecto hacer así, dado que los pesos atómicos estándar son masas atómicas relativas, aunque es menos específico. La masa atómica relativa también se refiere a ambientes no terrestres y ambientes terrestres altamente específicos que se desvían de la media o tienen diferentes certidumbres (número de cifras significativas) que los pesos atómicos estándar.
La masa isotópica relativa es la masa relativa de un isótopo dado (más específica, cualquier núclido solo), escalado con el carbono-12 como exactamente 12. No hay otros núclidos distintos al carbono-12 que tengan exactamente un número entero de masas en esta escala. Esto es debido a dos factores: [1] la diferente masa de neutrones y protones que actúan para cambiar la masa total en los núclidos con ratios protón/neutrón distintos al ratio 1:1 del carbono-12; y [2] no se encontrará un número exacto si existe una pérdida/ganancia de masa diferente a la energía de enlace nuclear relativa a la energía de enlace nuclear media del carbono-12. Sin embargo, puesto que cualquier defecto de masa debido a la energía de enlace nuclear es una fracción pequeña (menos del 1%) comparada con la masa de un nucleón (incluso menos comparado con la masa media por nucleón en el carbono-12, que está moderada a fuertemente unido), y dado que los protones y neutrones difieren en masa unos de otros por una fracción pequeña (aproximadamente 0,0014 uma, la práctica de redondear la masa atómica de cualquier núclido dado o isótopo al número entero más cercano, siempre da el número entero simple del conteo total de nucleones. El conteo de neutrones puede ser derivado por sustracción del número atómico.
Contenido
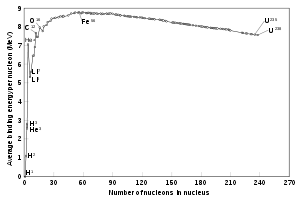
Defectos de masa en masas atómicas
La cantidad que las masas atómicas se desvían de su número de masa es como sigue: la desviación empieza positiva en el hidrógeno-1, disminuyendo hasta alcanzar un mínimo en el hierro-56, hierro-58 y níquel-62, luego aumenta a valores positivos en los isótopos más pesados, conforme aumenta el número atómico. Esto corresponde a lo siguiente: la fisión nuclear en un elemento más pesado que el hierro produce energía, y la fisión de cualquier elemento más ligero que el hierro requiere energía. Lo opuesto es verdadero para las reacciones de fusión nuclear: la fusión en los elementos más ligeros que el hierro produce energía, y la fusión en los elementos más pesados que el hierro requiere energía.
Medición de las masas atómicas
La comparación directa y medición de las masas de los átomos se logra con la espectrometría de masas atómico-molecular.
Factor de conversión entre unidad de masa atómica y gramos
La unidad científica estándar para manejar átomos en cantidades macroscópicas es el mol, que está definido arbitrariamente como la cantidad de sustancia que tiene tantos átomos u otra unidad como átomos hay en 12 gramos de carbono del isótopo C-12. El número de átomos en un mol es denominado número de Avogadro, cuyo valor es aproximadamente 6,023 x 1023 mol-1. Un mol de una sustancia siempre contiene exactamente la masa atómica relativa o masa molar de dicha sustancia, expresado en gramos; sin embargo, esto no es cierto para la masa atómica. Por ejemplo, el peso atómico estándar del hierro es 55,847 g/mol, y en consecuencia un mol de hierro como se suele encontrar en la Tierra tiene una masa de 55,847 gramos. La masa atómica del isótopo 56Fe es 55,935 u, y un mol de 56Fe pesará, en teoría, 55,935g, pero no se ha encontrado tales cantidades puras de isótopo 56Fe en la Tierra.
La fórmula para la conversión entre unidad de masa atómica y la masa SI en gramos para un solo átomo es:
donde Mu es la constante de masa molar y NA es el número de Avogadro.
Relación entre masa atómica y masa molecular
Se aplican definiciones similares a las moléculas. Se puede calcular la masa molecular de un compuesto por adición de las masas atómicas-moleculares de sus átomos constituyentes (núclidos). También se puede calcular la masa molar indefinida por la adición de las masas atómicas relativas de los elementos dados en la fórmula química. En ambos casos, la multiplicidad de los átomos (el número de veces que está presente) debe ser tomado en cuenta, generalmente multiplicando cada masa única por su multiplicidad inversa.
Historia
En la historia de la química, los primeros científicos en determinar los pesos atómicos fueron John Dalton entre 1803 y 1808, y Jöns Jakob Berzelius entre 1808 y 1826. Los pesos atómicos fueron definidos originalmente en relación al elemento hidrógeno, el más ligero, tomándolo como 1, y en 1820, la hipótesis de Prout indicaba que las masas atómicas de todos los elementos deberían ser un múltiplo entero del peso del hidrógeno. Sin embargo, Berzelius pronto probó que esta hipótesis no siempre se sostenía, y en algunos casos, como el cloro, el peso atómico caía casi exactamente entre dos múltiplos del peso del hidrógeno. Posteriormente, se mostró que esto se debía a un efecto causado por los isótopos, y que la masa atómica de los isótopos puros, o núclidos, era múltiplo de la masa del hidrógeno, en un margen de diferencia del 1%.
En la década de 1860, Stanislao Cannizzaro refinó los pesos atómicos aplicando la ley de Avogadro (en el Congreso de Karlsruhe de 1860). Formuló una ley para determinar los pesos atómicos de los elementos: las distintas cantidades del mismo elemento contenido en distintas moléculas son todas múltiplos enteros del peso atómico, y determinó los pesos atómicos y pesos moleculares comparando la densidad de vapor de un conjunto de gases con moléculas conteniendo uno o más del elemento químico en cuestión.[5]
A principios del siglo XX, hasta la década de 1960, los químicos y físicos utilizaban dos escalas de masa atómicas. Los químicos usaban una escala tal que la mezcla natural de isótopos de oxígeno tenía una masa atómica de 16, mientras que los físicos asignaron el mismo número 16 a la masa atómica del isótopo de oxígeno más común (que contiene ocho protones y ocho neutrones). Sin embargo, debido a que también están presentes en el oxígeno natural, tanto el oxígeno-17 como el oxígeno-18, esto conducía a 2 tablas diferentes de masas atómicas. La escala unificada, basada en el carbono-12, 12C, cumplía el requerimiento de los físicos de basar la escala en un isótopo puro, a la vez que se hacía numéricamente cercana a la escala de los químicos.
Véase también
Referencias
- ↑ International Union of Pure and Applied Chemistry. "atomic mass". «Compendium of Chemical Terminology» Internet edition (en inglés).
- ↑ IUPAC Definition of Standard Atomic Weight
- ↑ ATOMIC WEIGHTS OF THE ELEMENTS 2005 (IUPAC TECHNICAL REPORT), M. E. WIESER Pure Appl. Chem., V.78, pp. 2051, 2006
- ↑ International Union of Pure and Applied Chemistry. "relative atomic mass". «Compendium of Chemical Terminology» Internet edition (en inglés).
- ↑ Williams, Andrew (2007). «Origin of the Formulas of Dihydrogen and Other Simple Molecules». J. Chem. Ed. 84: pp. 1779.
Enlaces externos
- NIST relative atomic masses of all isotopes and the standard atomic weights of the elements
- Tutorial on the concept and measurement of atomic mass
- AME2003 Atomic Mass Evaluation del National Nuclear Data Center
- 'ATOMIC WEIGHT' -THE NAME, ITS HISTORY, DEFINITION, AND UNITS, P. DE BIEVRE and H. S. PEISER Pure&App. Chem., 64, 1535, 1992
Categorías:- Física atómica
- Propiedades químicas
- Estequiometría
- Masa
-
Wikimedia foundation. 2010.