- Análisis volumétrico
-
 Proceso de titulación. El valorante cae desde la bureta en la solución de analito contenida en el erlenmeyer. Un indicador presente en la solución cambia permanentemente de color al alcanzar el punto final de la valoración
Proceso de titulación. El valorante cae desde la bureta en la solución de analito contenida en el erlenmeyer. Un indicador presente en la solución cambia permanentemente de color al alcanzar el punto final de la valoraciónUtilizando una bureta calibrada para añadir el valorante es posible determinar la cantidad exacta que se ha consumido cuando se alcanza el punto final. El punto final es el punto en el que finaliza la valoración, y se determina mediante el uso de un indicador (ver más adelante). Idealmente es el mismo volumen que en el punto de equivalencia—el número de moles de valorante añadido es igual al número de moles de analito, algún múltiplo del mismo (como en los ácidos polipróticos. En la valoración clásica ácido fuerte-base fuerte, el punto final de la valoración es el punto en el que el pH del reactante es exactamente 7, y a menudo la solución cambia en este momento de color de forma permanente debido a un indicador. Sin embargo, existen muchos tipos diferentes de valoraciones (ver más adelante). Pueden usarse muchos métodos para indicar el punto final de una reacción: a menudo se usan indicadores visuales (cambian de color). En una titulación o valoración ácido-base simple, puede usarse un indicador de pH, como la fenolftaleína, que es normalmente incolora pero adquiere color rosa cuando el pH es igual o mayor que 8,2. Otro ejemplo es el naranja de metilo, de color rojo en medio ácido y amarillo en disoluciones básicas. No todas las titulaciones requieren un indicador. En algunos casos, o bien los reactivos o los productos son fuertemente coloreados y pueden servir como "indicador". Por ejemplo, una titulación o valoración redox que utiliza permanganato de potasio como disolución estándar (rosa/violeta) no requiere indicador porque sufre un cambio de color fácil de detectar pues queda incolora al reducirse el permanganato. Después del punto de equivalencia, hay un exceso de la disolución titulante (permanganato) y persiste un color rosado débil que no desaparece.
Debido a la naturaleza logarítmica de la curva de pH, las transiciones en el punto final son muy rápidas; y entonces, una simple gota puede cambiar el pH de modo muy significativo y provocar un cambio de color en el indicador. Hay una ligera diferencia entre el cambio de color del indicador y el punto de equivalencia de la titulación o valoración. Este error se denomina error del indicador. Por este motivo es aconsejable efectuar determinaciones en blanco con el indicador y restarle el resultado al volumen gastado en la valoración.
Contenido
Historia y etimología
La palabra "titulación" viene del vocablo latino titulus, que significa inscripción o título. La palabra francesa titre, del mismo origen, significa rango o grado. Una titulación o valoración es, por definición, la determinación del grado o concentración de una disolución con respecto a agua con pH 7 (que es el pH del H2O pura en condiciones estándar). Los orígenes del análisis volumétrico están en Francia en la química de finales del siglo XVII. François Antoine Henri Descroizilles desarrolló la primera bureta (con aspecto de un cilindro graduado) en 1791. Joseph Louis Gay-Lussac desarrolló una versión mejorada de la bureta que incluía un brazo lateral, y acuñó los términos "pipeta" y "bureta" en un artículo de 1824 sobre la estandarización de disoluciones de índigo. Un gran paso adelante en la metodología y popularización del análisis volumétrico se debe a Karl Friedrich Mohr, que rediseñó la bureta colocando un cierre con pinza y una cánula de vertido en el extremo inferior, y escribió el primer libro sobre su uso, con el título Lehrbuch der chemisch-analytischen Titrirmethode (Manual sobre métodos de titulación en Química Analítica), publicado en 1855.[1]
Preparación de una muestra para titulación o valoración
En un titulación o valoración, tanto la sustancia patrón como el analito deben estar en fase líquida (o en disolución). Si la muestra no es un líquido o una disolución, debe ser disuelta. Si el analito está muy concentrado en la muestra a analizar, suele diluirse. Aunque la amplia mayoría de las titulaciones se llevan a cabo en disolución acuosa, pueden usarse otros disolventes como ácido acético o etanol con igual finalidad, para determinados análisis. Una cantidad medida de muestra se coloca en un frasco donde se disuelve y se diluye si es necesario. El resultado matemático de la valoración puede calcularse directamente mediante la cantidad de valorante medida. Cuando la muestra ha sido disuelta o diluida previamente a la valoración, la cantidad de disolvente utilizado para disolver o diluir debe ser bien conocida (generalmente es un coeficiente entero) para poder considerarlo en el resultado matemático de la valoración de la muestra original. Muchas valoraciones requieren un cierto control del pH de la reacción. Para ello, se usan disoluciones amortiguadoras añadidas en el frasco de la disolución a analizar para mantener el pH de la solución. En otros casos se debe enmascarar un cierto ion: esto es necesario cuando hay dos reactivos en la muestra que pueden reaccionar con la sustancia patrón y solo queremos valorar uno de ellos, o bien cuando la reacción puede ser inhibida o alterada por la presencia de ese ion. Se procede añadiendo otra disolución a la muestra para enmascarar o secuestrar el ion no deseado, mediante la formación de un enlace débil con él o incluso formando una sustancia insoluble. Algunas reacciones redox pueden requerir calentar la disolución con la muestra y valorar mientras está todavía caliente (para incrementar la velocidad de reacción). Por ejemplo, la oxidación de ciertas soluciones de oxalato requiere calentar la solución hasta unos 60 grados centígrados para mantener una adecuada velocidad de reacción.
Procedimiento
Una titulación o valoración comienza con un vaso de precipitados o matraz Erlenmeyer conteniendo un volumen preciso del reactivo a analizar y una pequeña cantidad de indicador, colocado debajo de una bureta que contiene la disolución estándar. Controlando cuidadosamente la cantidad añadida, es posible detectar el punto en el que el indicador cambia de color. Si el indicador ha sido elegido correctamente, este debería ser también el punto de neutralización de los dos reactivos. Leyendo en la escala de la bureta sabremos con precisión el volumen de disolución añadida. Como la concentración de la disolución estándar y el volumen añadido son conocidos, podemos calcular el número de moles de esa sustancia (ya que Molaridad = moles / volumen). Luego, a partir de la ecuación química que representa el proceso que tiene lugar, podremos calcular el número de moles de la sustancia a analizar presentes en la muestra. Finalmente, dividiendo el número de moles de reactivo por su volumen, conoceremos la concentración buscada.
Curvas de valoración
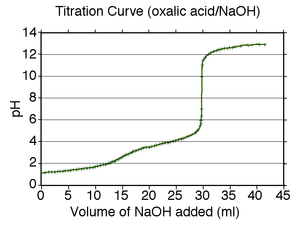 Una curva típica de valoración de un ácido diprótico, ácido oxálico, titulado con una base fuerte, hidróxido de sodio. Son visibles los dos puntos de equivalencia, a 15 y 30 mL
Una curva típica de valoración de un ácido diprótico, ácido oxálico, titulado con una base fuerte, hidróxido de sodio. Son visibles los dos puntos de equivalencia, a 15 y 30 mL
Las valoraciones se representan mediante curvas de valoración, en las que suele representarse como variable independiente el volumen añadido de disolución estándar, titulante o patrón, mientras la variable dependiente es la concentración del analito en la etapa correspondiente de valoración (en una valoración ácido-base es generalmente el pH de la disolución, que cambia según la composición de las dos disoluciones). En el caso de las valoraciones ácido-base, las curvas de valoración reflejan la fuerza del ácido y de la base correspondientes. Por ejemplo, en una valoración de ácido fuerte con una base débil, la curva de valoración será relativamente lisa, aunque muy escarpado para puntos cerca el punto de equivalencia de la valoración. En este caso, pequeños cambios en el volumen del valorante producen cambios grandes del pH cerca del punto de equivalencia. En este caso, una amplia gama de indicadores sería apropiada (por ejemplo el tornasol, la fenolftaleína o el azul de bromotimol). Por otro lado, si uno de los componentes de una valoración ácido-base es un ácido débil o una base débil, y el otro es un ácido fuerte o una base fuerte, la curva de valoración es claramente irregular cerca del punto de equivalencia (y el pH no cambia "tanto" con la adición de pequeños volúmenes de valorante). Como ejemplo, la curva de valoración del ácido oxálico (un ácido débil) con hidróxido de sodio (una base fuerte) se ha representado en la imagen anterior. Aquí, el punto de equivalencia ocurre a un pH entre 8 y 10, y así el analito es básico en el punto de equivalencia (con más precisión, el ion hidróxido experimenta una reacción de hidrólisis en el agua produciendo iones hidróxido). Un indicador como la fenolftaleína sería apropiado para esta valoración en particular. La curva de valoración correspondiente a una valoración de una base débil con un ácido fuerte se comporta de modo análogo, obteniéndose una disolución ácida en el punto de equivalencia. En este caso, indicadores como el naranja de metilo o el azul de bromotimol se utilizan habitualmente. Por otro lado, las valoraciones ácido-base en las que los componentes son una base y un ácido débil, son de naturaleza bastante irregular. Debido a la naturaleza de tales valoraciones, no hay ningún indicador químico apropiado, y por ello a menudo se utiliza el pHmetro.
Tipos de valoraciones
Las valoraciones se clasifican por el tipo de objeto a analizar:
- Valoraciones ácido-base: basadas en la reacción de neutralización entre el analito y una disolución de ácido o base que sirve de referencia. Para determinar el punto final, usan un indicador de pH, un pH-metro, o un medidor de conductancia.
- Valoraciones redox: basadas en la reacción de oxidación-reducción o reacción redox entre el analito y una disolución de oxidante o reductor que sirve de referencia. Para determinar el punto final, usan un potenciómetro o un indicador redox aunque a veces o bien la sustancia a analizar o la disolución estándar de referencia tienen un color suficientemente intenso para que no sea necesario un indicador adicional.
- Valoraciones de formación de complejos o complexometrías: basadas en la reacción de formación de un complejo entre el analito y la sustancia valorante. El agente quelante EDTA es muy usado para titular iones metálicos en disolución. Estas valoraciones generalmente requieren indicadores especializados que forman complejos más débiles con el analito. Un ejemplo es Negro de Eriocromo T para valoración de iones calcio, magnesio o cobre (II).
- Valoraciones de precipitación: Son aquellas basadas en las reacciones de precipitación.Uno de los tipos más habituales son las Argentometrías: precipitación de aniones como los halógenos ( F-, Cl-, Br-, I-) y el tiocianato (SCN-) con el ion plata. Ag+. Esta titulación está limitada por la falta de indicadores apropiados.[2]
NaX(ac) + AgNO3(ac) → AgX(s) + NaNO3(ac) donde X = F-, Cl-, Br-, I-, SCN-
Valoración ácido-base
Indicador Color en medio ácido Rango de cambio de color Color en medio básico Violeta de metilo Amarillo 0.0 - 1.6 Violeta Azul de bromofenol Amarillo 3.0 - 4.6 Azul Naranja de metilo Rojo 3.1 - 4.4 Amarillo Rojo de metilo Rojo 4.4 - 6.2 Amarillo Tornasol Rojo 5.0 - 8.0 Azul Azul de bromotimol Amarillo 6.0 - 7.6 Azul Fenolftaleína Incolora 8.3 - 10.0 Rosa Amarillo de alizarina Amarillo 10.1 - 12.0 Rojo Estas valoraciones están basadas en la reacción de neutralización que ocurre entre un ácido y una base, cuando se mezclan en solución. El ácido (o la base) se añade a una bureta previamente lavada con el mismo ácido (o base) antes de esta adición. La base (o el ácido) se añade a un matraz Erlenmeyer previamente lavado con agua destilada antes de la adición. La solución en el matraz es a menudo una solución estándar; cuya concentración es exactamente conocida. La solución en la bureta es la solución cuya concentración debe ser determinada por la valoración. El indicador usado para la valoración ácido-base a menudo depende de la naturaleza de los componentes como se ha descrito en la sección anterior. Los indicadores más comunes, sus colores, y el rango de pH del cambio de color se muestran en la tabla anterior. Cuando se requieren resultados más exactos, o cuando los componentes de la valoración son un ácido y una base débil, se utiliza un pHmetro o un medidor de conductancia.
Valoración redox
Estas valoraciones están basadas en una reacción de redox entre un agente oxidante y un agente reductor. El agente oxidante (o el agente reductor) se añade en la bureta previamente lavada con el mismo agente oxidante. El reductor (o el agente oxidante) se añade en el matraz erlenmeyer, previamente lavado con agua destilada. Como en una valoración ácido-base, la solución estándar es la que se coloca a menudo en el matraz, y la solución cuya concentración debe ser determinada se coloca en la bureta. El procedimiento para realizar las valoraciones redox es similar al requerido para realizar las valoraciones ácido-base.
La mayoría de las veces se utiliza un el potenciómetro o un indicador redox para determinar el punto final de la valoración. Por ejemplo, cuando uno de los componentes de la valoración es el agente oxidante dicromato de potasio, el cambio de color de la solución de naranja a verde no es definido y se utiliza un indicador como la difenilamina. El análisis de vinos para determinar su contenido de dióxido de azufre requiere el empleo de yodo como un agente oxidante. En este caso, se utiliza almidón como indicador; un complejo de almidón-yodo azul se forma en el momento en que un exceso de yodo está presente, señalando así el punto final de la valoración.
Por otro lado, algunas valoraciones redox no requieren un indicador, debido al color intenso de alguno de los componentes. Por ejemplo, en una valoración donde está presente el agente oxidante permanganato de potasio, un color rosado que persiste señala el punto final de la valoración, y por lo tanto no se requiere ningún indicador particular.
Valoración complexométrica
Estas valoraciones están basadas en la formación de un complejo entre el analito y el valorante. El agente quelatante EDTA se utiliza muy frecuentemente para valorar iones metálicos en solución. Estas valoraciones generalmente requieren un indicador especializado que forma complejos más débiles con el analito. Un ejemplo común es el Negro de Eriocromo T para la valoración de los iones de calcio y magnesio.
Valoración de potencial Zeta
Estas valoraciones son características de sistemas heterogéneos, como los coloides. El potencial Zeta juega el papel de indicador. Uno de los objetivos es la determinación del punto isoeléctrico cuando la carga superficial se hace 0. Esto se puede alcanzar cambiando el pH o añadiendo surfactante. Otro objetivo es la determinación de la dosis óptima de sustancia química para la floculación o la estabilización.
Medida del punto final de una titulación o valoración
Hay diferentes métodos para determinar el punto final o punto de equivalencia:
- Indicadores: Son sustancias que cambian de color en respuesta a un cambio químico.
- Indicador de pH o indicador ácido-base: Un indicador ácido-base (como la fenolftaleína) cambia de color dependiendo del pH del medio.
- Indicador Redox. Una gota de disolución de indicador es añadida al principio de la titulación o valoración; cuando el color cambia, se ha alcanzado el punto final.
- Potenciómetro: Son instrumentos que miden el potencial de electrodo de la disolución. Se usan para valoraciones redox; el potencial del electrodo de trabajo cambiará bruscamente en el punto final.
- Medidor de pH o pH-metros: Son potenciómetros que usan un electrodo cuyo potencial depende de la cantidad de ion H+ presente en la disolución. Es un ejemplo de un electrodo de ion selectivo que permite medir el pH de la disolución a lo largo de la valoración. En el punto final, cambiará bruscamente el pH medido. Puede ser un método más preciso que el uso de indicadores, y es fácil de automatizar.
- Conductancia: La conductividad de una disolución depende de los iones presentes en ella. Durante muchas titulaciones, la conductividad cambia de modo significativo. Por ejemplo, durante una valoración ácido-base, los iones H+ y OH- formando agua neutra, H2O. Esto cambia la conductividad de la disolución. La conductancia total de la disolución depende también de los otros iones presentes en la disolución (como los contraiones). No todos ellos contribuyen de igual manera a la conductividad que también dependerá de la movilidad de cada ion y de la concentración total de iones (fuerza iónica). Luego, predecir el cambio en la conductividad es más difícil que medirla.
- Cambio de color: En algunas reacciones, la disolución cambia de color sin presencia de indicador. Es frecuente en valoraciones redox, por ejemplo, cuando los diferentes estados de oxidación de productos y reactivos poseen diferentes colores.
- Precipitación: Si se forma un sólido en la reacción, y luego precipita. Un ejemplo es la reacción entre Ag+ y Cl- que forma una sal muy insoluble, AgCl. Esto dificulta determinar con precisión el punto final. Por ello, a veces se prefiere hacer una titulación inversa.
- Una valoración calorimétrica o titulación isotérmica usa el calor producido o consumido en la reacción para determinar el punto final. Es un método importante en bioquímica, como en la determinación de qué substratos se enlazan a las enzimas.
- Titulación termométrica es una técnica muy versátil. Se diferencia de la anterior por el hecho de que no se determina un aumento o caída de temperatura como indicativo del punto final, sino que se mide la velocidad de cambio de la temperatura.
 Titulación con determinación del punto final por cambio de color
Titulación con determinación del punto final por cambio de color
- Espectroscopía: Puede usarse para medir la absorción de luz por la disolución durante la valoración, y si el espectro del reactivo, sustancia patrón o producto es conocido, podría medirse su evolución con cantidades bastante pequeñas que permitirían conocer el punto final.
- Amperometría o valoración amperométrica: Se usa como técnica de detección analizando la corriente eléctrica debida a la oxidación o reducción de los reactivos o productos en un electrodo de trabajo que dependerá de la concentración de las especies en disolución. El punto final se detecta por un cambio en la corriente. Este método es el más útil cuando hay que reducir un exceso de la sustancia valorante (valoración por retroceso), como es el caso de la valoración de haluros con Ag+.
Valoración por retroceso
El método de valoración por retroceso se usa cuando se invierte el sentido de la valoración, cambiando la sustancia a valorar. En vez de valorar el analito original se añade un exceso conocido de reactivo estándar a la disolución, y luego se valora el exceso. Este método es útil si el punto final de la valoración por retroceso es más fácil de identificar que el punto final de la valoración normal. Se usa también si la reacción entre el analito y la sustancia titulante es muy lenta.
Algunos usos particulares
- La valoración de biocombustible es el acto de determinar la acidez de una muestra de combustible de origen vegetal mediante la adición de una base a la muestra mientras se comprueba con papel indicador que el pH final es 7. Sabiendo cuánta base neutraliza una cantidad de biocombustible, conoceremos cuanta base en total añadiremos al lote completo.
- La valoración en petroquímica o en la industria alimentaria se usa para definir las propiedades de aceites, grasas y substancias similares.[3]
Algunas valoraciones aplicables a lípidos
- Número ácido: Determina el nivel de ácidos grasos libres presentes en un biocombustible. El número ácido total es la cantidad de base, expresada en miligramos de hidróxido de potasio que se requiere para neutralizar todos los componentes acídicos presentes en un gramo de muestra.
- Grado de acidez: Se realiza una titulación ácido-base con indicador de cambio de color para determinar el contenido de ácido graso libre en una muestra y comprobar así su acidez.
- Número de iodo o Índice de yodo: Es una medida del grado de insaturación de los componentes de una grasa. Será tanto mayor cuanto mayor sea el número de dobles enlaces C=C por unidad de grasa, utilizándose por ello para comprobar la pureza y la identidad de las grasas. Es la cantidad (gramos) de yodo absorbidos por 100 gramos de grasa.
El número de yodo oscila entre 0 (ácidos grasos saturados) a 350. Una valoración redox con cambio de color permite indicar la cantidad de ácido graso insaturado libre en una muestra.[4]
- Número de saponificación: La saponificación consiste en una hidrólisis alcalina de una muestra grasa (con KOH o NaOH). Los lípidos derivados de ácidos grasos (ácidos monocarboxílicos de cadena larga) dan lugar a sales alcalinas (jabones) y alcohol, que son fácilmente extraíbles en medio acuoso.
El número de saponificación no es más que los miligramos de KOH necesarios para saponificar 1 gramo de materia grasa. Esta prueba es otra prueba cualitativa que podemos aplicar a los lípidos. Esta nos permite ver si el tipo de lípido es saponificable (contiene ácidos grasos) o no (no contiene ácidos grasos). Se realiza una valoración ácido-base por retroceso con indicador de cambio de color o valoración potenciométrica para obtener una idea de la longitud media de la cadena de ácidos grasos en un nacis
Referencias
- ↑ Louis Rosenfeld. Four Centuries de Clinical Chemistry. CRC Press, 1999, p. 72-75.
- ↑ Presentación (ppt) sobre volumetrías. Ver enlace [1]
- ↑ Ejemplos de valoración en petroquímica o en la industria alimentaria [2].
- ↑ Caracterización de lípidos. http://www.pucmmsti.edu.do/cienciasfisiologicas/LIPIDOS-SIB.PDF
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Análisis volumétricoCommons.
Wikimedia Commons alberga contenido multimedia sobre Análisis volumétricoCommons.- Science aid: Titration una explicación simple de la titulación o valoración dirigida a jóvenes (en Inglés)
- Titulación o valoración - Instrumental, técnica y cálculos (en Inglés)
- Titulación o valoración - Simulación de curvas pH vs. volumen, diagramas de distribución y análisis de datos reales (en Inglés)
- Monografía Metrohm: Práctica de titulación o valoración
- Monografía Metrohm: Práctica de titulación de un termómetro
- Fundamentos de titulación o valoración: Guía (pdf-en Inglés) de METTLER TOLEDO
Wikimedia foundation. 2010.