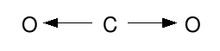- Momento dipolar químico
-
Se define como momento dipolar químico (μ) a la medida de la intensidad de la fuerza de atracción entre dos átomos, es la expresión de la asimetría de la carga eléctrica. Está definido como el producto entre la distancia "d" que separa a las cargas (longitud del enlace) y el valor de las cargas iguales y opuestas en un enlace químico:

Usualmente se encuentra expresado en Debyes (1 D = 1 A . 1 ues). El valor de q puede interpretarse como el grado de compartición de la carga, es decir, según las diferencias de electronegatividad, que porcentaje (100q) de la carga compartida por el enlace covalente está desplazada hacia la carga en cuestión. Dicho de otro modo, q representa qué parte de un electrón está siendo "sentida" de más o de menos por las cargas en cuestión.
Vector μ
Es de suma importancia la participación del momento dipolar como un vector con dirección hacia el átomo más electronegativo del enlace. Tomemos el ejemplo del dióxido de carbono (CO2), debido a la diferencia de electronegatividades en los enlaces C-O encontramos un μ diferente de 0, pero la molécula de CO2, experimentalmente, demuestra no ser polar. Esto se debe a que la geometría molecular del CO2 determina que ambos vectores μ de los dos enlaces C-O se cancelen por suma vectorial. Esto demuestra que la polaridad de las moléculas depende tanto de los momentos dipolares de enlace, como de la geometría molecular determinada por la TREPEV, lo que resulta en un momento dipolar molecular (suma vectorial de los momentos dipolares parciales).
Importancia de μ en la Atracción dipolo-dipolo
La intensidad de las fuerzas de atracción entre moléculas polares (dipolo-dipolo) está determinada por el momento dipolar de cada una de ellas, actuando de manera directamente proporcional. Así, mientras más polar sea la molécula (mayor μ), mayor será la intensidad de las fuerzas de atracción intermoleculares de tipo dipolo-dipolo que presente la sustancia.
Véase también
- Fuerzas intermoleculares
- Enlace químico
- Polaridad (química)
Wikimedia foundation. 2010.