- Mutación
-
 Gato doméstico (Felis silvestris catus) albino. El albinismo en este caso está asociado a una mutación de la enzima tirosinasa.[1]
Gato doméstico (Felis silvestris catus) albino. El albinismo en este caso está asociado a una mutación de la enzima tirosinasa.[1]
La mutación en genética y biología, es una alteración o cambio en la información genética (genotipo) de un ser vivo y que, por lo tanto, va a producir un cambio de características, que se presenta súbita y espontáneamente, y que se puede transmitir o heredar a la descendencia. La unidad genética capaz de mutar es el gen que es la unidad de información hereditaria que forma parte del ADN. En los seres multicelulares, las mutaciones sólo pueden ser heredadas cuando afectan a las células reproductivas. Una consecuencia de las mutaciones puede ser una enfermedad genética, sin embargo, aunque en el corto plazo puede parecer perjudiciales, a largo plazo las mutaciones son esenciales para nuestra existencia. Sin mutación no habría cambio y sin cambio la vida no podría evolucionar.[2] [3]
Definición
La definición que en su obra de 1901 "La teoría de la mutación" Hugo de Vries dio de la mutación (del latín mutare = cambiar) era la de cualquier cambio heredable en el material hereditario que no se puede explicar mediante segregación o recombinación. Más tarde se descubrió que lo que De Vries llamó mutación en realidad eran más bien recombinaciones entre genes.
La definición de mutación a partir del conocimiento de que el material hereditario es el ADN y de la propuesta de la doble hélice para explicar la estructura del material hereditario (Watson y Crick,1953), sería que una mutación es cualquier cambio en la secuencia de nucleótidos del ADN. Cuando dicha mutación afecta a un sólo gen, se denomina mutación génica. Cuando es la estructura de uno o varios cromosomas lo que se ve afectado, mutación cromosómica. Y cuando una o varias mutaciones provocan alteraciones en todo el genoma se denominan, mutaciones genómicas.
Mutación somática y mutación en la línea germinal
- Mutación somática: es la que afecta a las células somáticas del individuo. Como consecuencia aparecen individuos mosaico que poseen dos líneas celulares diferentes con distinto genotipo. Una vez que una célula sufre una mutación, todas las células que derivan de ella por divisiones mitóticas heredarán la mutación (herencia celular). Un individuo mosaico originado por una mutación somática posee un grupo de células con un genotipo diferente al resto, cuanto antes se haya dado la mutación en el desarrollo del individuo mayor será la proporción de células con distinto genotipo. En el supuesto de que la mutación se hubiera dado después de la primera división del cigoto (en estado de dos células), la mitad de las células del individuo adulto tendrían un genotipo y la otra mitad otro distinto. Las mutaciones que afectan solamente a las células de la línea somática no se transmiten a la siguiente generación.[2] [3]
- Mutaciones en la línea germinal: son las que afectan a las células productoras de gametos apareciendo, de este modo, gametos con mutaciones. Estas mutaciones se transmiten a la siguiente generación y tienen una mayor importancia desde el punto de vista evolutivo.[2] [3]
Tipos de mutación según sus consecuencias
Las consecuencias fenotípicas de las mutaciones son muy variadas, desde grandes cambios hasta pequeñas diferencias tan sutiles que es necesario emplear técnicas muy desarrolladas para su detección.[2] [3]
Mutaciones morfológicas
Afectan a la morfología del individuo, a su distribución corporal. Modifican el color o la forma de cualquier órgano de un animal o de una planta. Suelen producir malformaciones. Un ejemplo de una mutación que produce malformaciones en humanos es aquella que determina la neurofibromatosis. Esta es una enfermedad hereditaria, relativamente frecuente (1 en 3.000 individuos), producida por una mutación en el cromosoma 17 y que tiene una penetrancia del 100% y expresividad variable. Sus manifestaciones principales son la presencia de neurofibromas, glioma del nervio óptico, manchas cutáneas de color café con leche, hamartomas del iris, alteraciones óseas (displasia del esfenoide, adelgazamiento de la cortical de huesos largos). Con frecuencia hay retardo mental y macrocefalia.[4]
Mutaciones letales y deletéreas
Son las que afectan la supervivencia de los individuos, ocasionándoles la muerte antes de alcanzar la madurez sexual. Cuando la mutación no produce la muerte, sino una disminución de la capacidad del individuo para sobrevivir y/o reproducirse, se dice que la mutación es deletérea. Este tipo de mutaciones suelen producirse por cambios inesperados en genes que son esenciales o imprescindibles para la supervivencia del individuo. En general las mutaciones letales son recesivas, es decir, se manifiestan solamente en homocigosis o bien, en hemicigosis para aquellos genes ligados al cromosoma X en humanos, por ejemplo.[2] [5]
Mutaciones condicionales
Son aquellas que sólo presentan el fenotipo mutante en determinadas condiciones ambientales (denominadas condiciones restrictivas), mostrando la característica silvestre en las demás condiciones del medio ambiente (condiciones permisivas). Un ejemplo es la mutación Curly en Drosophila melanogaster que se manifiesta como las puntas de las alas del insecto curvadas hacia arriba. A temperaturas permisivas de 20 a 25 °C (las cuales son, por otro lado, las típicas del cultivo de este organismo) las moscas homocigóticas para el factor Curly no se diferencian de las moscas normales. No obstante, bajo condiciones restrictivas de temperaturas menores a 18 °C, las moscas Curly manifiestan su fenotipo mutante.[5]
Mutaciones bioquímicas o nutritivas
Son los cambios que generan una pérdida o un cambio de alguna función bioquímica como, por ejemplo, la actividad de una determinada enzima. Se detectan ya que el organismo que presenta esta mutación no puede crecer o proliferar en un medio de cultivo por ejemplo, a no ser que se le suministre un compuesto determinado. Los microorganismos constituyen un material de elección para estudiar este tipo de mutaciones ya que las cepas silvestres solo necesitan para crecer un medio compuesto por sales inorgánicas y una fuente de energía como la glucosa. Ese tipo de medio se denomina mínimo y las cepas que crecen en él se dicen prototróficas. Cualquier cepa mutante para un gen que produce una enzima perteneciente a una vía metabólica determinada, requerirá que se suplemente el medio de cultivo mínimo con el producto final de la vía o ruta metabólica que se encuentra alterada. Esa cepa se llama auxotrófica y presenta una mutación bioquímica o nutritiva.[6]
Mutaciones de pérdida de función
Las mutaciones suelen determinar que la función del gen en cuestión no se pueda llevar a cabo correctamente, por lo que desaparece alguna función del organismo que la presenta. Este tipo de mutaciones, las que suelen ser recesivas, se denominan mutaciones de pérdida de función. Un ejemplo es la mutación del gen hTPH2 que produce la enzima triptófano hidroxilasa en humanos. Esta enzima está involucrada en la producción de serotonina en el cerebro. Una mutación (G1463A) de hTPH2 determina aproximadamente un 80% de pérdida de función de la enzima, lo que se traduce en una disminución en la producción de serotonina y se manifiesta en un tipo de depresión llamada depresión unipolar.[7]
Mutaciones de ganancia de función
Cuando ocurre un cambio en el ADN, lo más normal es que corrompa algún proceso normal del ser vivo. Sin embargo, existen raras ocasiones donde una mutación puede producir una nueva función al gen, generando un fenotipo nuevo. Si ese gen mantiene la función original, o si se trata de un gen duplicado, puede dar lugar a un primer paso en la evolución. Un caso es la resistencia a antibióticos desarrollada por algunas bacterias.
Tipos de mutación según el mecanismo causal
Según el mecanismo que ha provocado el cambio en el material genético, se suele hablar de tres tipos de mutaciones: mutaciones cariotípicas o genómicas, mutaciones cromosómicas y mutaciones génicas o moleculares. En el siguiente cuadro se describen los diferentes tipos de mutaciones y los mecanismos causales de cada una de ellas.[2] [3]
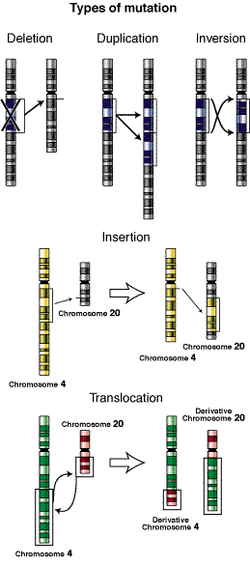
Por sustitución de bases molecular Por inserciones o deleciones de bases Inversiones Mutación cromosómica Deleciones o duplicaciones Translocaciones Poliploidía genómica Aneuploidía Hay una tendencia actual a considerar como mutaciones en sentido estricto solamente las génicas, mientras que los otros tipos entrarían en el término de aberraciones cromosómicas.
 Mutación de ojos blancos en Drosophila melanogaster
Mutación de ojos blancos en Drosophila melanogaster
 Individuo "silvestre" de ojos rojos en Drosophila melanogaster
Individuo "silvestre" de ojos rojos en Drosophila melanogaster
Mutaciones cromosómicas
Definición
Las mutaciones cromosómicas son modificaciones en el número total de cromosomas, la duplicación o supresión de genes o de segmentos de un cromosoma y la reordenación del material genético dentro o entre cromosomas. Pueden ser vistas al microscopio, sometiendo a los cromosomas a la “técnica de bandas”. De esta manera se podrá confeccionar el cariotipo.
Introducción
- Las alteraciones de la dotación diploide de cromosomas se denominan aberraciones cromosómicas o mutaciones cromosómicas.
- Hay 3 tipos de mutaciones cromosómicas:
- Reordenamientos cromosómicos: implican cambios en la estructura de los cromosomas (duplicación, deleción, inversión y traslocación).
- Aneuploidías:supone un aumento o disminución en el número de cromosomas.
- Poliploidia: presencia de conjuntos adicionales de cromosomas.
- La aneuploidia: da lugar a monosomías, trisomías, tetrasomías, etc.
- La poliploidia: dotaciones de cromosomas pueden tener orígenes idénticos o distintos, dando lugar a autopoliploides y alopoloploides, respectivamente.
- Las deleciones y duplicaciones pueden modificar grandes segmentos del cromosoma.
- Las inversiones y translocaciones dan lugar a una pequeña o ninguna pérdida de información genética.
- Los lugares frágiles son constricciones o brechas que aparecen en regiones particulares de los cromosomas con una predisposición a romperse en determinadas condiciones.
- El estudio de las series normales y anormales de cromosomas se conoce como citogenética.
Variación en el número de cromosomas
En las células somáticas hay un mecanismo que inactiva a todos los cromosomas X menos uno, la ganancia o perdida de un cromosoma sexual en genoma diploide altera el fenotipo normal , dando lugar a los síndromes de Klinefelter o de Turner, respectivamente. Tal variación cromosómica se origina como un error aleatorio durante la producción de gametos. La no disyunción es el fallo de los cromosomas o de las cromatidas en separarse y desplazarse a los polos opuestos en la meiosis. Cuando esto ocurre se desbarata la distribución normal de los cromosomas en los gametos. El cromosoma afectado puede dar lugar a gametos anormales con dos miembros o con ninguno. La fecundación de estos con un gameto haploide normal da lugar a zigotos con tres miembros (trisomía) o con solo uno (monosomía) de este cromosoma. La no disyunción da lugar a una serie de situaciones aneuploides autosómicas en la especie humana y en otros organismos.
Síndrome de Klinefelter
El síndrome de Klinefelter se considera la anomalía gonosómica más común en los humanos. Los afectados presentan un cromosoma “X” supernumerario lo que conduce a fallo testicular primario con infertilidad e hipoandrogenismo. A pesar de la relativa frecuencia del padecimiento en recién nacidos vivos, se estima que la mitad de los productos 47, XXY se abortan de manera espontánea.
Síndrome de Turner
El síndrome de Turner o Monosomía X es una enfermedad genética caracterizada por presencia de un solo cromosoma X. La falta de cromosoma Y determina el sexo femenino de todos los individuos afectados, y la ausencia de todo o parte del segundo cromosoma X determina la falta de desarrollo de los caracteres sexuales primarios y secundarios. Esto confiere a las mujeres que padecen el síndrome de Turner un aspecto infantil e infertilidad de por vida.
Aneuploidía
La aneuploidía es la alteración en la cantidad de uno de los tipos de cromosomas homólogos.
Variaciones en estructura y ordenación de los cromosomas
El otro tipo de aberración cromosómicas incluye cambios estructurales que eliminan, añaden o reordenan partes sustanciales de uno o más cromosomas, se encuentran las deleciones y las duplicaciones de gene o de parte de un cromosoma y las reordenaciones del material genético mediante las que segmentos de un cromosoma se invierten, se intercambian con un segmento de un cromosoma no homologo o simplemente se transfieren a otro cromosoma. Los intercambios y las transferencias se denominan translocaciones, en las que la localización de un gen esta cambiada dentro del genoma. Estos cambios estructurales se deben a una o más roturas distribuidas a lo largo del cromosoma, seguidas por la pérdida o la reordenación del material genético. Los cromosomas pueden romperse espontáneamente, pero la tasa de roturas puede aumentar en células expuestas a sustancias químicas o a radiación. Aunque los extremos normales de los cromosomas, los telómeros, no se fusionan fácilmente con extremos nuevos de cromosomas rotos o con otros telómeros, los extremos producidos en los puntos de rotura son “pegajosos” y pueden reunirse con otros extremos rotos. Si la rotura y reunión no restablece las relaciones originales y si la alteración se produce en el plasma germinal, los gametos tendrán una reordenación estructural que será heredable. Si la aberración se encuentra en un homologo, pero no en el otro, se dice que los individuos son heterocigotos para la aberración. En tales casos se producen configuraciones raras en el apareamiento durante la sinapsis meiótica. Si no hay pérdida o ganancia de material genético, los individuos que llevan la aberración en heterocigosis en uno de los dos homólogos probablemente no quedaran afectados en su fenotipo. Los complicados apareamientos de las ordenaciones dan lugar a menudo a gametos con duplicaciones o deficiencias de algunas regiones cromosómicas. Cuando esto ocurre, los descendientes de “portadores” de ciertas aberraciones tienen a menudo una mayor probabilidad de presentar cambios fenotípicos.
Mutaciones cromosómicas y cáncer
La mayoría de los tumores contienen varios tipos de mutaciones cromosómicas. Algunos tumores se asocian con deleciones, inversiones o translocaciones específicos.
- Las deleciones pueden eliminar o inactivar los genes que controlan el ciclo celular;
- Las inversiones y las translocaciones pueden causar rupturas en los genes supresores de tumores, fusionar genes que producen proteínas cancerígenas o mover genes a nuevas ubicaciones, donde quedan bajo la influencia de diferentes secuencias reguladoras.
- El papel de las mutaciones en el cáncer.
Las mutaciones en los genes regulatorios claves (los supresores de tumor y los protooncogenes) alteran el estado de las células y pueden causar el crecimiento irregular visto en el cáncer. Para casi todos los tipos de cáncer que se han estudiado hasta la fecha, parece que la transición de una célula sana y normal a una célula cancerosa es una progresión por pasos que requiere cambios genéticos en varios oncogenes y supresores de tumor diferentes. Esta es la razón por la cual el cáncer es mucho más prevalente en individuos de edades mayores. Para generar una célula cancerosa, una series de mutaciones deben ocurrir en la misma célula. Ya que la probabilidad de que cualquier gen sea mutado es muy baja, es razonable decir que la probabilidad de varias mutaciones en la misma célula es aún más improbable.
Mutaciones genómicas o numéricas
Son las mutaciones que afectan al número de cromosomas o todo el complemento cromosómico (todo el genoma).
- Poliploidía: Es la mutación que consiste en el aumento del número normal de “juegos de cromosomas” . Los seres poliploides pueden ser autopoliploides, si todos los juegos proceden de la misma especie, o alopoliploides, si proceden de la hibridación, es decir, del cruce de dos especies diferentes.
- Haploidía: Son las mutaciones que provocan una disminución en el número de juegos de cromosomas.
- Aneuploidía: Son las mutaciones que afectan sólo a un número de ejemplares de un cromosoma o más, pero sin llegar a afectar al juego completo. Las aneuploidías pueden ser monosomías, trisomías, tetrasomías, etc, cuando en lugar de dos ejemplares de cada tipo de cromosomas, que es lo normal, hay o sólo uno, o tres, o cuatro, etc. Entre las aneuplodías podemos encontrar diferentes tipos de trastornos genéticos en humanos como pueden ser:
- Trisomía 21 o Síndrome de Down que tienen 47 cromosomas.
- Trisomía 18 o Síndrome de Edwards. También tienen 47 cromosomas.
- Monosomía X o Síndrome de Turner.
- Trisomía sexual XXX o Síndrome del triple X.
- Trisomía sexual XXY o Síndrome de Klinefelter.
- Trisomía sexual XYY o Síndrome del doble Y.
- Cromosoma extra Síndrome de Down.
Mutaciones génicas o moleculares
Son las mutaciones que alteran la secuencia de nucleótidos del ADN. Estas mutaciones pueden llevar a la sustitución de aminoácidos en las proteínas resultantes (se denominan mutaciones no sinónimas). Un cambio en un solo aminoácido puede no ser importante si es conservativo y ocurre fuera del sitio activo de la proteína. Así, existen las denominadas mutaciones sinónimas o "mutaciones silenciosas" en las que la mutación altera la base situada en la tercera posición del codón pero no causa sustitución aminoacídica debido a la redundáncia del código genético. El aminoácido insertado será el mismo que antes de la mutación. También, en el caso de las mutaciones neutras, el aminoácido insertado es distinto pero con unas propiedades fisicoquímicas similares, por ejemplo la sustitucion de glutámico por aspártico puede no tener efectos funcionales en la proteína debido a que los dos son ácidos y similares en tamaño. También podrían considerarse neutras aquellas mutaciones que afecten a zonas del genoma sin función aparente, como las repeticiones en tándem o dispersas, las zonas intergénicas y los intrones.[8]
De lo contrario, la mutación génica o también llamada puntual, puede tener consecuencias severas, como por ejemplo:
- La sustitución de valina por ácido glutámico en la posición 6 de la cadena
polipéptidica de la beta-globina da lugar a la enfermedad anemia falciforme en individuos homocigóticos debido a que la cadena modificada tiene tendencia a cristalizar a bajas concentraciones de oxígeno.
- Las proteínas del colágeno constituyen una familia de moléculas estructuralmente
relacionadas que son vitales para la integridad de muchos tejidos incluidos la piel y los huesos. La molécula madura del colágeno está compuesta por 3 cadenas polipeptídicasunidas en una triple hélice. Las cadenas se asocian primero por su extrempo C-terminal y luego se enroscan hacia el extremo N-terminal. Para lograr este plegado, las cadenas de colágeno tienen una estructura repetitiva de 3 aminoácidos: glicina - X - Y (X es generalmente prolina y Y puede ser cualquiera de un gran rango de aminoácidos). Una mutación puntual que cambie un solo aminoácido puede distorsionar la asociación de las cadenas por su extremo C-terminal evitando la formación de la triple hélice, lo que puede tener consecuencias severas. Una cadena mutante puede evitar la formación de la triple hélice, aun cuando haya 2 monómeros de tipo salvaje. Al no tratarse de una enzima, la pequeña cantidad de colágeno funcional producido no puede ser regulada. La consecuencia puede ser la condición dominante letal osteogénesis imperfecta.
Bases moleculares de la mutación génica
- Mutación por sustitución de bases: Se producen al cambiar en una posición un par de bases por otro (son las bases nitrogenadas las que distinguen los nucleótidos de una cadena). Distinguimos dos tipos que se producen por diferentes mecanismos bioquímicos:[8]
- Mutaciones transicionales o simplemente transiciones, cuando un par de bases es sustituido por su alternativa del mismo tipo. Las dos bases púricas son adenina (A) y guanina (G), y las dos pirimídicas son citosina (C) y timina (T). La sustitución de un par AT, por ejemplo, por un par GC, sería una transición.
- Mutaciones transversionales o transversiones, cuando un par de bases es sustituida por otra del otro tipo. Por ejemplo, la sustitución del par AT por TA o por CG.
- Mutaciones de corrimiento estructural, cuando se añaden o se quitan pares de nucleótidos alterándose la longitud de la cadena. Si se añaden o quitan pares en un número que no sea múltiplo de tres (es decir si no se trata de un número exacto de codones), las consecuencias son especialmente graves, porque a partir de ese punto, y no sólo en él, toda la información queda alterada. Hay dos casos:
- Mutación por pérdida o deleción de nucleótidos: en la secuencia de nucleótidos se pierde uno y la cadena se acorta en una unidad.
- Mutación por inserción de nuevos nucleótidos: Dentro de la secuencia del ADN se introducen nucleótidos adicionales, interpuestos entre los que ya había, alargándose correspondientemente la cadena.[8]
- Mutaciones en los sitios de corte y empalme (Splicing)
Las mutaciones de corrimiento del marco de lectura también pueden surgir por mutaciones que interfieren con el splicing del ARN mensajero. El comienzo y final de cada intrón en un gen están definidos por secuencias conservadas de ADN. Si un nucleótido muta en una de las posiciones altamente conservada, el sitio no funcionará más, con las consecuencias predecibles para el ARNm maduro y la proteína codificada. Hay muchos ejemplos de estas mutaciones, por ejemplo, algunas mutaciones en el gen de la beta globina en la beta talasemia son causadas por mutaciones de los sitios de splicing.
Mutaciones espontáneas o inducidas
Las mutaciones pueden ser espontáneas o inducidas. Las primeras son aquellas que surgen normalmente como consecuencia de errores durante el proceso de replicación del ADN. Tales errores ocurren con una probabilidad de 10 ^ -7 en células haploides y 10 ^ -14 en diploides.[8]
Mutaciones inducidas
Las mutaciones inducidas surgen como consecuencia de la exposición a mutágenos químicos o biológicos o a radiaciones. Entre los mutágenos químicos se pueden citar:
- los análogos de bases del ADN (como la 2-aminopurina), moléculas que se parecen estructuralmente a las bases púricas o pirimidínicas pero que muestran propiedades de apareamiento erróneas;
- los agentes alquilantes como la nitrosoguanidina, que reacciona directamente con el ADN originando cambios químicos en una u otra base y produciendo también apareamientos erróneos;
- y, por último, los agentes intercalantes como las acridinas, que se intercalan entre 2 pares de bases del ADN, separándolas entre sí.
Como mutágenos biológicos podemos considerar la existencia de transposones o virus capaces de integrarse en el genoma.
Las radiaciones ionizantes (rayos X, rayos cósmicos y rayos gamma) y no ionizantes (sobre todo la radiación ultravioleta) también inducen mutaciones en el ADN; las primeras se originan por los radicales libres que reaccionan con el ADN inactivándolo, y las segundas aparecen como consecuencia de la formación de dímeros de pirimidina en el ADN, es decir, como consecuencia de la unión covalente de 2 bases pirimidínicas adyacentes.
Un agente utilizado a menudo para inducir mutaciones (mutagénesis) en organismos experimentales es el EMS (sulfato de etilmetano). Este mutágeno puede alterar la secuencia del DNA de diversas maneras como modificar químicamente las bases de G en DNA. Esta alteración en la secuencia de un gen se conoce como mutación puntual.
Mutaciones espontáneas
Las principales causas de las mutaciones que se producen de forma natural o normal en las poblaciones son tres: los errores durante la replicación del ADN, las lesiones o daños fortuitos en el ADN y la movilización en el genoma de los elementos genéticos transponibles.
Errores en la replicación
Durante la replicación del ADN pueden ocurrir diversos tipos de errores que conducen a la generación de mutaciones. Los tres tipos de errores más frecuentes son:
- La tautomería: las bases nitrogenadas se encuentran habitualmente en su forma cetónica y con menos frecuencia aparecen en su forma tautomérica enólica o imino. Las formas tautoméricas o enólicas de las bases nitrogenadas (A*, T*, G* y C*) muestran relaciones de apareamiento distintas que las formas cetónicas: A*-C, T*-G, G*-T y C*-A. El cambio de la forma normal cetónica a la forma enólica produce transiciones. Los errores en el apareamiento incorrecto de las bases nitrogenadas pueden ser detectados por la función correctora de pruebas de la ADN polimerasa III.
- Las mutaciones de cambio de fase o pauta de lectura: se trata de inserciones o deleciones de uno o muy pocos nucleótidos. Según un modelo propuesto por Streisinger, estas mutaciones se producen con frecuencia en regiones con secuencias repetidas. En las regiones con secuencias repetidas, por ejemplo, TTTTTTTTTT..., o por ejemplo, GCGCGCGCGCGCG...., durante la replicación se puede producir el deslizamiento de una de las dos hélices (la hélice molde o la de nueva síntesis) dando lugar a lo que se llama "apareamiento erróneo deslizado". El deslizamiento de la hélice de nueva síntesis da lugar a una adición, mientras que el deslizamiento de la hélice molde origina una deleción. En el gen lac I (gen estructural de la proteína represora) de E. coli se han encontrado puntos calientes (regiones en las que la mutación es muy frecuente) que coinciden con secuencias repetidas: un ejemplo es el punto caliente CTGG CTGG CTGG.
- Deleciones y duplicaciones grandes: las deleciones y duplicaciones de regiones relativamente grandes también se han detectado con bastante frecuencia en regiones con secuencias repetidas. En el gen lac I de E. coli se han detectado deleciones grandes que tienen lugar entre secuencias repetidas. Se cree que estas mutaciones podrían producirse por un sistema semejante al propuesto por Streisinger ("Apareamiento erróneo deslizado") o bien por entrecruzamiento desigual.[8]
Lesiones o daños fortuitos en el ADN
 Antennapedia en Drosophila melanogaster
Antennapedia en Drosophila melanogaster
 D. melanogaster types (clockwise): brown eyes with black body, cinnabar eyes, sepia eyes with ebony body, vermilion eyes, white eyes, and wild-type eyes with yellow bodyDrosophila melanogaster
D. melanogaster types (clockwise): brown eyes with black body, cinnabar eyes, sepia eyes with ebony body, vermilion eyes, white eyes, and wild-type eyes with yellow bodyDrosophila melanogaster
 Drosophila melanogaster mutation: yellow cross-veinless forked fruit fly.Drosophila melanogaster
Drosophila melanogaster mutation: yellow cross-veinless forked fruit fly.Drosophila melanogaster
Pueden darse tres tipos de daños fortuitos en el ADN:
- La despurinización consiste en la ruptura del enlace glucosídico entre la base nitrogenada y el azúcar al que está unida con pérdida de una adenina o de una guanina . Como consecuencia aparecen sitios apurínicas (o sea, sin bases púricas). Existe un sistema de reparación de este tipo de lesiones en el ADN. Este tipo de lesión es la más recurrente o frecuente: se estima que se produce una pérdida de 10.000 cada 20 horas a 37 °C.
- La desaminación consiste en la pérdida de grupos amino. La citosina por desaminación se convierte en uracilo y el uracilo empareja con adenina produciéndose transiciones: GC→AT. El uracilo no forma parte del ADN, existiéndo un enzima llamada glucosidasa de uracilo encargada de detectar la presencia de este tipo de base en el ADN y retirarlo. Al retirar el uracilo se produce una sede o sitio apirimidínica. La 5-Metil-Citosina (5-Me-C) por desaminación se convierte en Timina (T). La Timina (T) es una base normal en el ADN y no se retira, por tanto estos errores no se reparan. Este tipo de mutación también genera transiciones.
- Los daños oxidativos en el ADN. El metabolismo aeróbico produce radicales superoxido O2, peróxido de hidrógeno H2O2 e hidroxilo. Estos radicales producen daños en el ADN, y una de las principales alteraciones que originan es la transformación de la guanina en 8-oxo-7,8-dihidro-desoxiguanina que aparea con la Adenina. La 8-oxo-7,8-dihidro-desoxiguanina recibe el nombre abreviado de 8-oxo-G. Esta alteración del ADN produce transversiones: GC→TA.[8]
Elementos genéticos transponibles
Los elementos genéticos transponibles son secuencias de ADN que tienen la propiedad de cambiar de posición dentro del genoma, por tal causa también reciben el nombre de elementos genéticos móviles. Por tanto, cuando cambian de posición y abandonan el lugar en el que estaban, en ese sitio, se produce un deleción o pérdida de bases. Si el elemento transponible estaba insertado en el interior de un gen, puede que se recupere la función de dicho gen. De igual forma, si el elemento genético móvil al cambiar de posición se inserta dentro de un gen se produce una adición de una gran cantidad de nucleótidos que tendrá como consecuencia la pérdida de la función de dicho gen. Por consiguiente, los elementos genéticos transponibles producen mutaciones.
Su existencia fue propuesta por Barbara McClintock (1951 a 1957) en el maíz. Sin embargo, su existencia no se demostró hasta mucho más tarde en bacterias. En el fenómeno de la transposición no se ha encontrado una relación clara entre la secuencia de la sede donadora (lugar en el que está el transposón) y la sede aceptora (lugar al que se incorpora el transposón). Algunos transposones muestran una preferencia por una determinada región (zona de 2000 a 3000 pares de bases), pero dentro de ella parecen insertarse al azar.
- Transposones en Bacterias
En Bacterias existen dos tipos de transposones:
- Transposón Simple, Secuencia de Inserción o Elemento de Inserción (IS): los transposones simples contienen una secuencia central con información para la transposasa y en los extremos una secuencia repetida en orden inverso. Esta secuencia repetida en orden inverso no es necesariamente idéntica, aunque muy parecida. Cuando un transposón simple se integra en luna determinado punto del ADN aparece una repetición directa de la secuencia diana (5-12 pb).
- Transposón Compuesto (Tn): contienen un elemento de inserción (IS) en cada extremo en orden directo o inverso y una región central que además suele contener informaciión de otro tipo. Por ejemplo, los Factores de transferencia de resistencia (RTF), poseen información en la zona central para resistencia a antibióticos (cloranfenicol, kanamicina, tetraciclina, etc.).
Tanto los elementos IS como los transposones compuestos (Tn) tienen que estar integrados en otra molécula de ADN, el cromosoma principal bacteriano o en un plasmidio, nunca se encuentran libres.
- Transposones en eucariotas
- Transposones en plantas
Los transposones fueron descubiertos por Barbara McClintock (entre 1951 y 1957) en maíz, sin embargo, cuando postuló su existencia la comunidad científica no comprendió adecuadamente sus trabajos. Años más tarde, ella misma comparó los "elementos controladores" que había descrito (elementos cromosómicos transponibles) de maíz con los transposones de los plasmidios. Sus trabajos recibieron el Premio Nobel en 1983.
Dentro de las familias de elementos controladores de maíz se pueden distinguir dos clases:
-
- Los elementos autónomos: capaces de escindirse de la sede donadora y transponerse.
-
- Los elementos no autónomos: son estables, y solamente se vuelven inestables en presencia de los autónomos en posición trans.
En el sistema Ac-Ds (Activador-Disociación) estudiado por McClintock, Ac es el elemento autónomo y Ds es el elemento no autónomo. Además del sistema Ac-Ds en maíz se han descrito otros sistemas como el Mu (Mutador), sistema Spm (Supresor-Mutador), sistema R-stippled y sistema MrRm. También se han encontrado transposones en otras especies de plantas, tales como en la "boca de dragón" o "conejito" (Anthirrhinum majus), en Petunia y en soja (Glycine max), etc..
- Transposones en mamíferos
En mamíferos se conocen tres clases de secuencias que son capaces de transponerse o cambiar de posición a través de un ARN intermediario:
-
- Retrovirus endógenos: semejantes a los retrovirus, no pueden infectar nuevas células y están restringidos a un genoma, pero pueden transponerse dentro de la célula. Poseen largas secuencias repetidas en los extremos (LTR), genes env (con información para la proteína de la cubierta) y genes que codifican para la trasnrciptasa inversa, como los presentes en retrovirus.
-
- Retrotransposones o retroposones: carecen de LTR y de los genes env (con información para la proteína de la cubierta) de retrovirus. Contienen genes para la transcriptasa inversa y pueden transponerse. Tienen una secuencia rica en pares A-T en un extremo. Un ejemplo, son los elementos LINE-1 (elementos largos dispersos) en humanos y ratones.
-
- Retropseudogenes: carecen de genes para la transcriptasa inversa y por consiguiente son incapaces de transponerse de forma independiente, aunque si pueden cambiar de posición en presencia de otros elementos móviles que posean información para la trasncriptasa inversa. Poseen una región rica en pares A-T en un extremo y los hay de dos tipos:
- Pseudogenes procesados: están en bajo número de copias y derivan de genes transcritos por la ARN Poilimerasa II, siendo genes que codifican para polipéptidos. Estos pseudogenes procesados carecen de intrones.
- SINES (elementos cortos dispersos): están en alto número de copias en mamíferos. Dos ejemplos son la secuencia Alu de humanos y B1 de ratón, que derivan de genes transcritos por la ARN polimerasa III utilizando un promotor interno.
- Retropseudogenes: carecen de genes para la transcriptasa inversa y por consiguiente son incapaces de transponerse de forma independiente, aunque si pueden cambiar de posición en presencia de otros elementos móviles que posean información para la trasncriptasa inversa. Poseen una región rica en pares A-T en un extremo y los hay de dos tipos:
La secuencia Alu es la más abundante en el genoma humano, existiendo 750.000 copias dispersas por el genoma, aproximadamente existe una copia cada 4000 pb. Esta secuencia posee un contenido relativamente alto en (G+C) y presenta una elevada homología (70-80%) con la secuencia B1 de ratón. Se la denomina secuencia Alu por poseer en su interior una diana para la endonucleasa de restricción Alu. Las secuencias Alu humanas tienen alrededor de 280 pb y están flanqueadas por repeticiones directas cortas (6-18 pb). Una secuencia típica Alu es un dímero repetido en tandem, la unidad que se repite tiene un tamaño aproximado de 120 pb y va seguida de una corta secuencia rica en pares A-T. Sin embargo, existe una asimetría en las unidades repetidas, de manera que la segunda unidad contiene una secuencia de 32 pb ausente en la primera. Las unidades repetidas de la secuencia Alu muestran un elevado parecido con la secuencia del ARN 7SL, un componente que juega un papel importante en el transporte de las proteínas a través de la membrana del retículo endoplasmático.
Dominancia y recesividad de las mutaciones
La mayoría de las mutaciones son recesivas
La mayoría de las mutaciones son recesivas debido a que la mayor parte de los genes codifica para enzimas. Si un gen es inactivado la reducción en el nivel de actividad de la enzima puede no ser superior al 50% ya que el nivel de transcripción del gen remanente puede aumentarse por regulación en respuesta a cualquier aumento en a concentración del sustrato. Asimismo, la proteína en si misma puede estar sujeta a regulación (por fosforilación, por ejemplo) de tal forma que su actividad pueda ser aumentada para compensar cualquier falta en el número de moléculas. En cualquier caso, a menos que la enzima controle la velocidad del paso limitante en la ruta bioquímica, una reducción en la cantidad de producto puede no importar. l fenotipo. Esta enfermedad es causada por mutaciones en el gen que codifica para la enzima fenilalanina hidroxilasa, la cual convierte el aminoácido fenilalanina a tirosina. Si un individuo es homocigota para alelos que eliminen completamente cualquier actividad de esta enzima, la fenilalanina no podrá ser metabolizada y aumentará sus niveles en sangre hasta un punto en el cual comienza a ser dañina para el cerebro en desarrollo. Es de rutina determinar esta condición en los recién nacidos mediante el análisis de una pequeña gota de sangre (Test Guthrie). Este estudio ha revelado que existen pocas personas con una condición conocida como Hiperfenilalaninemia Benigna. Estos individuos tienen niveles moderadamente altos fenilalanina en sangre. Sus niveles de fenilalanina hidroxilasa constituyen aproximadamente el 5% del normal. A pesar de esto, son aparentemente perfectamente saludables y no sufren de las anormailidades cerebrales causadas por la falta total de la actividad enzimática.
Mutaciones dominantes
Haploinsuficiencia
En este caso, la cantidad de producto de un gen no es suficiente para que el metabolismo sea el normal. Quizás la enzima producida sea la responsable de regular la velocidad del paso limitante en una reacción de una ruta metabólica. La telangiectasia hemorrágica hereditaria es una displasia vascular autosómica dominante que lleva a telangiectasias y malformaciones arteriovenosas de la piel, mucosas y vísceras, provocando ocasionalmente la muerte por sangrados incontrolados. Está causada por una mutación en el gen ENG, que codifica para la endoglina, proteína receptora del factor beta transformante de crecimiento (TGF-beta). Quizás el TGF-beta no sea capaz de ejercer un efecto suficiente en las células cuando sólo está presente la mitad de la cantidad normal del receptor.[9] [10] [11]
Efecto dominante negativo
Ciertas enzimas tiene una estructura multimérica (compuesta por varias unidades) y la inserción de un componente defectuoso dentro de esa estructura puede destruir la actividad de todo el complejo. El producto de un gen defectuoso, entonces, interfiere con la acción del alelo normal. Ejemplos de este efecto son las mutaciones que causan la osteogénesis imperfecta y ciertos tumores intestinales.[12] [13]
Ganancia de función
Es imposible imaginar que por una mutación un gen pueda ganar una nueva atividad, pero quizá el sitio activo de una enzima pueda ser alterado de tal forma que desarrolle especificidad por un nuevo sustrato. Si esto es así, cómo puede ocurrir la evolución? Ejemplos en genética humana de genes con 2 alelos tan diferentes son raras pero un ejemplo está dado por el locus ABO. La diferencia entre los loci A y B está determinada por 7 cambios nucleotídicos que llevaron a cambios en 4 aminoácidos. Probablemente sólo uno de estos cambios es responsable del cambio en especificidad entre las enzimas alfa-3-N-acetil-D-galactosaminiltransferasa (A) y alfa-3-D-galactosiltransferasa. También hay muchos ejemplos de la evolución humana donde muchos genes se han duplicado y en consecuencia han divergido en sus especificidades por el sustrato. En el cromosoma 14 hay un pequeño grupo de 3 genes relacionados, alfa-1-antitripsina (AAT), alfa-1-antiquimotripsina (ACT) y un gen relacionado que ha divergido de tal forma que probablemente ya no sea funcional. Las relaciones estructurales entre AAT y ACT son muy obvias y ambos son inhibidores de proteasas, pero ahora claramente cumplen roles levemente diferentes debido a que tienen diferentes actividades contra un rango de proteasas y están bajo una regulación diferente.
Dominancia a nivel organísmico pero recesividad a nivel celular
Algunos de los mejores ejemplos de esto se ecuentran en el área de la genética del cáncer. Un ejemplo típico sería el de un gen supresor de tumor como en retinoblastoma.
Tasas de mutación
Las tasas de mutación han sido medidas en una gran variedad de organismos. En mamíferos la tasa de mutación de 1 en 2.2 * 109 bases núcleotídicas,[14] mientras que, en el otro extremo de la escala los virus de ARN tienen una tasa de mutación del orden de 1 en 106.[15] La cantidad de mutaciones tiene relación con el tipo de enzima involucrada en la copia del material genético. Esta enzima (ADN o ARN Polimerasa, según el caso) tiene distintas tasas de error y esto incide directamente en el número final de mutaciones. A pesar de que la incidencia de las mutaciones es relativamente grande en relación con el número de organismos de cada especie, la evolución no depende solo de las mutaciones que surgen en cada generación, sino de la interacción de toda esta acumulación de variabilidad con la selección natural y la deriva genética durante la evolución de las especies.
Mutaciones y polimorfismos
Las mutaciones pueden considerarse patológicas o anormales, mientras que los polimorfismos son variaciones normales en la secuencia del ADN entre unos individuos a otros y que superan el uno por ciento en la población, por lo que no puede considerarse patológico. La mayoría de los polimorfismos proceden de mutaciones silentes.
Mutación y evolución
Las mutaciones son la materia prima de la evolución. La evolución tiene lugar cuando una nueva versión de un gen, que originalmente surge por una mutación, aumenta su frecuencia y se extiende a la especie gracias a la selección natural o a tendencias genéticas aleatorias (fluctuaciones casuales en la frecuencia de los genes). Antes se pensaba que las mutaciones dirigían la evolución, pero en la actualidad se cree que la principal fuerza directora de la evolución es la selección natural, no las mutaciones. No obstante, sin mutaciones las especies no evolucionarían.
La selección natural actúa para incrementar la frecuencia de las mutaciones ventajosas, que es como se produce el cambio evolutivo, ya que esos organismos con mutaciones ventajosas tienen más posibilidades de sobrevivir, reproducirse y transmitir las mutaciones a su descendencia.
La selección natural actúa para eliminar las mutaciones desventajosas; por tanto, está actuando continuamente para proteger a la especie de la decadencia mutacional. Sin embargo, la mutación desventajosa surge a la misma velocidad a la que la selección natural la elimina, por lo que las poblaciones nunca están completamente limpias de formas mutantes desventajosas de los genes. Esas mutaciones que no resultan ventajosas pueden ser el origen de enfermedades genéticas que pueden transmitirse a la siguiente generación.
La selección natural no actúa sobre las mutaciones neutrales, pero las mutaciones neutrales pueden cambiar de frecuencia por procesos aleatorios. Existen controversias sobre el porcentaje de mutaciones que son neutrales, pero generalmente se acepta que, dentro de las mutaciones no neutras, las mutaciones desventajosas son mucho más frecuentes que las mutaciones ventajosas. Por tanto, la selección natural suele actuar para reducir el porcentaje de mutaciones al mínimo posible; de hecho, el porcentaje de mutaciones observado es bastante bajo.
Mutación y cáncer
El cáncer está causado por alteraciones en oncogenes, genes supresores de tumores y/o genes de micro ARN. Un solo cambio genético es usualmente insuficiente para que se desarrolle un tumor maligno. La mayor parte de la evidencia indica que tal desarrollo involucra un proceso de varios pasos secuenciales en los cuales ocurren alteraciones en varios, frecuentemente muchos, de estos genes.[16] Un oncogén es un gen que, cuando es desregulado, participa en el inicio y desarrollo del cáncer. Las mutaciones génicas que dan como resultado la activación de los oncogenes incrementan la posibilidad de que una célula normal se convierta en una célula tumoral. Desde la década de los '70 se han identificado docenas de oncogenes en los seres humanos. Los oncogenes, al menos en sentido figurado, son los perpetuos antagonitas de los genes supresores tumorales, los cuales actúan previniendo el daño del ADN y mantienen las funciones celulares bajo un equilibrado control. Existe mucha evidencia que apoya la noción de que la pérdida o inactivación por mutaciones puntuales de los genes supresores de tumores puede llevar a una célula a transformarse en cancerosa.[17] Los oncogenes se originan a partir de mutaciones en genes normales, llamados proto-oncogenes. Los proto-oncogenes usualmente codifican para proteínas que ayudan a regular el ciclo celular o la diferenciación celular y se hallan frecuentemente involucrados en la transducción de señal y en la ejecución de señales mitogénicas.<.[18] Se ha descubierto, por otro lado, que los micro ARNs (pequeños ARNs de 20 a 25 nucléotidos de longitud) pueden controlar la expresión de los oncogenes regulándolos negativamente.[19] Por esa razón, las mutaciones en los micro ARNs pueden llevar a la activación de los oncogenes.[20]
Hipermutación somática
La hipermutación somática (o SHM, por sus siglas en inglés) es un mecanismo celular, que forma parte del modo en cómo se adapta el sistema inmune a nuevos elementos extraños (por ejemplo bacterias). Su función es diversificar los receptores que usa el sistema inmunitario para reconocer elementos extraños (antígeno) y permite al sistema inmune adaptar su respuesta a las nuevas amenazas que se producen a lo largo de la vida de un organismo.[21] La hipermutación somática implica un proceso de mutación programada que afecta a las regiones variables de los genes de inmunoglobulina. A diferencia de muchos otros tipos de mutación, la SHM afecta solo a células inmunitarias individuales y sus mutaciones, por lo tanto, no se trasmiten a la descendencia.[21]
Diferentes tipos de mutación
La mutación se define tradicionalmente como una modificación en la información genética, producida por un cambio brusco y de tipo hereditario, interviniendo uno o varios caractéres.
Sin embargo, la puesta en evidencia del ADN como soporte químico de la información genética y la posibilidad de acceder al conocimiento específico de la secuencia de nucleotidos que caracteriza cada cromosoma a llevado a proponer una nueva definición: Todo cambio que afecta la sequencia de nucleotidos es una mutación.[22]
Mutaciones y Genética de Poblaciones
Ademas, a nivel de la genética de población se define como un error en la reproducción conforme al mensaje hereditario. Ella va a transformar un alelo en otro, nuevo o ya existente en la población. El rol de la mutación en la evolución es primordial, porque es la única fuente de genes nuevos. Sin embargo, una vez que un nuevo gen ha aparecido en la población, ya no es él mismo quien va a determinar su futuro: si este nuevo alelo es más favorable o desfavorable que los antiguos, será la Selección natural que va a determinar la evolución posterior de su frecuencia en la población.[23]
A nivel de población, la persistencia depende de la mantención de la información genética. Para lograr esto, los organismos intentan disminuir la tasa de mutación y limitar las mutaciones deletereas. Sin embargo, la adaptación a nuevas situaciones necesita un cierto nivel de variación genética para obtener mutaciones raras y benéficas. El numero de mutaciones de una población es determinado por el tamaño de ella, ademas de la tasa de mutación del organismo. En consecuencia, para todo tamaño de población determinado, un organimos deberá desarrollar una tasa de mutación que optimise entre las mutaciones deletereas comunes, y las raras mutaciones beneficiosas, que aumentan la fitness a largo plazo. La relación optima entre costo y beneficio deberá cambiar de acuerdo a las circunstancias y los habitos de vida. Una tasa de mutación elevada podria ser más costosa para un organismo bien adaptado a su medioambiente constante, que para un organismo mal adaptado a un medioambiente que esta en continuo cambio.[24] De cualquier manera y en general, la tasa de mutación es minimizada por la selección. Hay, por otro lado, argumentos teoricos que muestran que las mutaciones pueden ser seleccionados positivamente por el hecho de crecer en un medioambiente determinado, donde la selección necesita de mutantes raros repetidos y que la variabilidad genética es limitada. Esto sucede cuando la población es pequeña y los mutantes raros pueden ofrecer una ventaja selectiva (por ejemplo resistencia a los antibióticos) más importante que el costo selectivo para la fitness.
Por ejemplo, en el caso de VIH, numerosas mutaciones aleatorias se producen a cada ciclo de la replicación viral, debido a la poca fidelidad que posee la transcriptasa inversa durante la transcripción. Algunas de estas mutaciones seran seleccionadas, por la presión que ejercen los Linfocitos T Citotoxicos (CTL) especificos para los epitopes salvajes. O las respuestas citotoxicas tempranas parecen tener una actividad anti-viral más eficaz, y el escape a esta respuesta explicaria la progresión viral.[25] [26]
Tipos de Mutación en el VIH
Diferentes tipos de mutaciones pueden perturbar la presentación de moleculas del CMHI. Mutaciones a nivel de regiones colindantes de los epitopes van a intervenir con la capacidad de separación de proteinas virales por el proteosoma o con la capacidad de transporte celular. De la misma manera, mutaciones que suceden en los epitopes mismos, disminuyen la respuesta citotoxica específica para los CTL. Si estas mutaciones conciernen los residuos de anclaje, ellas podrian provocar una inhibición completa de la unión del peptido con las moleculas de CMHI.
En fin, las mutaciones relacionadas con los aminoacidos relacionados con los residuos de anclaje en los epitopes pueden igualmente modificar la interacción del peptido con la molecula del CMHI por motivos de conformación espacial. Si la unión CMHI-Peptido no es estable, el complejo es separado antes de la unión con el TCR (T Cell Receptor) y el reconocimiento del peptido por los linfocitos t citotoxicos no se llevará a cabo. Es asi como el virus de VIH esta obligado a estar en un permanente equilibrio entre las mutaciones de escape a la respuesta inmune y el costo funcional para él que podrian estar ligadas a estas mutaciones, como una dismución en la fitness o de su poder infectante. Por otro lado, ha sido demostrado que en el caso de la respuesta por los CTL, las mutaciones ocurridas en regiones funcionales importantes conducirian a la no viabilidad de estos mutantes. Por ejemplo, mutaciones de escape a CTL en regiones codantes Gag p-24 van a producir una disminución significativa en la fitness viral, por el contrario una mutación de escape en laa regiones codantes Env gp-120 no tienen efecto en la fitness viral.[27] [28]
Véase también
Notas
- ↑ DL Imes, LA Geary, RA Grahn, and LA Lyons: ‘‘Albinism in the domestic cat (Felis catus) is associated with a tyrosinase (TYR) mutation.‘‘ Anim Genet. 2006 April; 37(2): 175–178. doi: 10.1111/j.1365-2052.2005.01409.x. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=16573534
- ↑ a b c d e f Stickberger, M.W.. (1985) Genetics. 3rd. Macmillan, New York.ISBN 978-0-02-418070-4.
- ↑ a b c d e Klug, W.S. & Cummings, M.R.. (2000) Concepts of genetics. 6th. Prentice Hall.
- ↑ Chuaqui, B. Capítulo 9. Neuropatología. FACOMATOSIS, MALFORMACIONES Y LESIONES ENCEFALICAS PERINATALES. [1]
- ↑ a b Fernández Peralta, A.M. 2002. Fundamentos moleculares y citogenéticos de la variación genética. En: Genética, Capítulo 22. . Ed. Ariel, España. ISBN 84-344-8056-5
- ↑ E. L. Tatum, R. W. Barratt, Nils Fries and David Bonner. 1950. Biochemical Mutant Strains of Neurospora Produced by Physical and Chemical Treatment. American Journal of Botany, Vol. 37, No. 1, pp. 38-46
- ↑ X. Zhang, R. Gainetdinov, J. Beaulieu, T. Sotnikova, L. Burch, R. Williams, D. Schwartz, K. Krishnan, M. Caron. 2004. Loss-of-Function Mutation in Tryptophan Hydroxylase-2 Identified in Unipolar Major Depression. Neuron, Volume 45, Issue 1, Pages 11-16
- ↑ a b c d e f Griffiths A.J. F. , William M. Gelbart, Jeffrey H. Miller and Richard Lewontin (1999).The Molecular Basis of Mutation. In Modern Genetic Analysis. W. H. Freeman and Company ISBN 0-7167-3597-0.
- ↑ Yamaguchi, H.; Azuma, H.; Shigekiyo, T.; Inoue, H.; Saito, S. (1997), «A novel missense mutation in the endoglin gene in hereditary hemorrhagic telangiectasia», Thrombosis and haemostasis 77 (2): 243–247, http://cat.inist.fr/?aModele=afficheN
- ↑ Sweet, K.; Willis, J.; Zhou, X.P.; Gallione, C.; Sawada, T.; Alhopuro, P.; Khoo, S.K.; Patocs, A. et ál. (2006), Classification Moleculaire Des Patients Ayant Une Polypose Hamartomateuse Ou Hyperplasique, 295, pp. a4, http://jamafr.ama-assn.org/cgi/content/abstract/295/1/a4
- ↑ Gallione, C.J.; Scheessele, E.A.; Reinhardt, D.; Duits, A.J.; Berg, J.N.; Westermann, C.J.J.; Marchuk, D.A. (2000), «Two common endoglin mutations in families with hereditary hemorrhagic telangiectasia in the», Human Genetics 107 (1): 40–44, doi:, http://www.springerlink.com/index/UB0DV0YJN1JHTARP.pdf
- ↑ Byers, P. H.; Wallis, G. A.; Willing, M. C. (1991), «Osteogenesis imperfecta: translation of mutation to phenotype», Journal of Medical Genetics 28 (7): 433, doi:, PMID 1895312, http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1016951
- ↑ Mahmoud, N.N. (1997), «Apc gene mutation is associated with a dominant-negative effect upon intestinal cell migration», Cancer Research 57 (22): 5045–5050, http://cancerres.aacrjournals.org/cgi/reprint/57/22/5045.pdf
- ↑ Kumar, Sudhir & Subramanian, Sankar. 2002. Mutation rates in mammalian genomes. Proceedings of the National Academy of Sciences of the United States of America. 99, 803-808.
- ↑ Malpicaa, Fraile y otros. 2002. The Rate and Character of Spontaneous Mutation in an RNA Virus. Genetics, Vol. 162, 1505-1511
- ↑ Croce CM. 2008. Oncogenes and cancer. N Engl J Med. 2008 31;358(5):502-11.
- ↑ Yokota J (2000 Mar). «"Tumor progression and metastasis"». Carcinogenesis. 21 (3): pp. 497–503. doi:. PMID 10688870.Free full text
- ↑ Todd R, Wong DT (1999). «"Oncogenes"». Anticancer Res. 19 (6A): pp. 4729–46. PMID 10697588.
- ↑ Negrini, M; Ferracin M, Sabbioni S, Croce CM (Jun 2007). «MicroRNAs in human cancer: from research to therapy». Journal of Cell Science 120 (11): pp. 1833–1840. http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=ShowDetailView&TermToSearch=17515481.
- ↑ Esquela-Kerscher, A; Slack FJ (Apr 2006). «Oncomirs - microRNAs with a role in cancer». Nature Reviews Cancer 6 (4): pp. 259–269. http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=ShowDetailView&TermToSearch=16557279&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVAbstractPlus.
- ↑ a b Oprea, M. (1999) Antibody Repertoires and Pathogen Recognition: The Role of Germline Diversity and Somatic Hypermutation Universidad de Leeds.
- ↑ Jean-Luc Rossignol et al. 2004.Génétique Genes et Génomes. Dunod. France. 232p
- ↑ Jean-Pierre Henry et pierre-Henry Gouyon.2008. Précis de génétique des populations. Dunod. France. 186p
- ↑ De visser Ja, Rozen De. 2005. Limits to Adaptation in asexual populations. J Evol Biol 18: 779-88
- ↑ Rainey PB. 1999. Evolutionary Genetics: The economics of mutation.Curr Biol 9: 371-3
- ↑ Sniegowski et al. 2000. The evolution of mutation rates: separating causes from consequences. Bioessays 22: 1057-66
- ↑ Troyer et al.2009. Variable Fitness Impact of HIV-1 Escape Mutations to Cytotoxic T lymphocyte (CTL) Response. Plos Pathogens 5(4): e1000365. doi:10.1371/journal.ppat.1000365
- ↑ Stankovic et al.2004. Échappement moléculaire à la réponse immune T cytotoxique : le cas des protéines non structurales du virus de l’immunodéficience humaine et simienne. Virologie 2:143-51
Bibliografía
- Klug, W.S., Cummings, M.R. y Spencer, C.A. (2006) Conceptos de Genética. 8ª .edición. Pearson Prentice Hall. Madrid: 213-239
- Pierce, B.A. (2005) Genética: Un enfoque conceptual. 2ª. edición. Edit. Medica Panamericana. Madrid.
- Griffiths, A.J.F.; Wessler, S.R.; Lewontin, R.C. y Carroll, S.B. (2008) Genética. 9ª. edición. McGraw-Hill. Interamericana. Madrid.
- Griffths, A.J.F; Gelbart, W.M.; Miller, J.H.; Lewontin, R.C. (2000) Genetica moderna. McGraw-Hill/ Interamericana.
- Brown, T.A.(2008) Genomas. 3ª. edición. Editorial Medica Panamericana.
- Lewin, B. (2008). Genes IX. McGraw-Hill/Interamericana.
- Fernández Piqueras J, Fernández Peralta AM, Santos Hernández J, González Aguilera JJ (2002) Genética. Ariel Ciencia.
- Hartl DL, Jones EW (2009) Genetics. Analysis of genes and genomes.
- Alberts, Bruce, et al. Molecular Biology of the Cell, 4th ed. New York: Garland Publishing, 2000.
- Atherly, Alan G., Jack R. Girton, and John F. McDonald. The Science of Genetics. Philadelphia, PA: Saunders College Publishing, 1998.
- Cooper, D. N. Human Gene Mutation. Bios Scientific Publishers Ltd., 1997.
- Departamento de Genética. Facultad de Genética. Universidad Complutense de Madrid. Mutación. [2]
- Facultad de Ciencias Exactas y Naturales. Mutación. [3]
- Griffiths Anthony J. F. , William M. Gelbart, Jeffrey H. Miller and Richard Lewontin hgxcjhjhgdafjkkfjb(http://www.ncbi.nlm.nih.gov/books/bv.fcgi?highlight=mutation&rid=mga.section.1052#1060 Mutational Analysis]. In Modern Genetic Analysis. W. H. Freeman and Company ISBN 0-7167-3597-0.
- Griffiths Anthony J. F. , William M. Gelbart, Jeffrey H. Miller and Richard Lewontin (1999).The Molecular Basis of Mutation. In Modern Genetic Analysis. W. H. Freeman and Company ISBN 0-7167-3597-0.
- Brown, T.A. (1999) Genomes. Oxford: Bios Scientfic Publishers. ISBN 978-0-471-31618-3
- John, B. (1990) Meiosis. Cambridge University Press. ISBN 978-0-521-35053-2
- Lewin, B.. (1999) Genes VII. Oxford University Press.
- Rees, H. & Jones, R.N.. (1977) Chromosome genetics. Arnold.
- Stickberger, M.W.. (1985) Genetics. 3rd. Macmillan, New York. ISBN 978-0-02-418070-4
- Klug, W.S. & Cummings, M.R.. (2000) Concepts of genetics. 6th. Prentice Hall.
- Kimura, Motoo. Population Genetics, Molecular Evolution, and the Neutral Allele Theory: Selected Papers. Chicago: University of Chicago Press, 1994. ISBN 978-0-226-43562-6 |
- Lewontin, Richard C. The Genetic Basis of Evolutionary Change. New York: Columbia University Press, 1974.
- Ohta, T. "The Nearly Neutral Theory of Molecular Evolution." Annual Review of Ecology and Systematics 23 (1992): 263–286.
- Radman, Miroslav. "Mutation: Enzymes of Evolutionary Change." Nature 401 (1999): 866–868.
- Woodruff, R. C., and John N. Thompson, eds. Contemporary Issues in Genetics and Evolution, Vol. 7: Mutation and Evolution. Dordrecht, The Netherlands: Kluwer Academic Publishing, 1998.
- Chapter 7, The Molecular Basis of Mutation in Modern Genetic Analysis by Anthony J. F. Griffiths, William M. Gelbart, Jeffrey H. Miller and Richard C. Lewontin (1999) published by..
- Lacadena, Juan Ramón. Genética. Madrid: Ediciones AGESA, 3ª ed., 1981. Tratado de genética; *Lewontin, R.C. La base genética de la evolución. Barcelona: Ediciones Omega, 1979.
- Puertas, M. J. Genética: fundamentos y perspectivas. Madrid: McGraw-Hill - Interamericana de España,1890.
Enlaces externos
- Mutaciones: La incesante transformación del genoma
- Mutación en Biology Reference Mutation
- Mutación en Columbia Encyclopedia
- Mutación: la extraña marca del horror de Hiroshima. Museo Virtual Leyendo el Libro de la Vida
- Una mutación ocurrida hace 100 millones de años marcó la evolución en Diario ABC
 Wikimedia Commons alberga contenido multimedia sobre MutaciónCommons.
Wikimedia Commons alberga contenido multimedia sobre MutaciónCommons.-
El contenido de este artículo incorpora material de una entrada de la Enciclopedia Libre Universal, publicada en español bajo la licencia Creative Commons Compartir-Igual 3.0.
Categorías:- Mutación
- Genética
- Evolución
- Recursos de la ciencia ficción
- Efectos de la radiactividad
Wikimedia foundation. 2010.