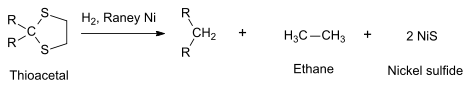- Níquel Raney
-
El níquel Raney es un catalizador sólido compuesto por granos muy finos de una aleación de níquel-aluminio. Se usa en muchos procesos industriales. Fue desarrollado en 1926 por el ingeniero estadounidense Murray Raney,[1] como catalizador alternativo para la hidrogenación industrial de algunos aceites vegetales. En tiempos recientes se ha usado mucho como catalizador heterogéneo en una gran variedad de síntesis orgánicas, generalmente hidrogenaciones.
El níquel Raney se produce tratando un bloque de aleación Ni-Al con una solución concentrada de hidróxido de sodio. Este tratamiento, llamado "activación", disuelve la mayor parte del aluminio presente en el bloque, dejando una estructura de níquel porosa con una gran área superficial, lo que le confiere su gran actividad catalítica. Un catalizador típico tiene un 85% en masa de níquel, porcentaje que corresponde a unos dos átomos de níquel por cada átomo de aluminio. El aluminio que queda tras la activación contribuye a preservar la estructura porosa del catalizador.
Debido a que Raney es una marca registrada por W.R. Grace & Co., sólo los productos de Grace Davidson son llamados "Níquel Raney"; los catalizadores producidos mediante esta técnica se denominan "catalizadores porosos" o "catalizadores de esponja metálica", ya que tienen propiedades parecidas al níquel Raney.
Contenido
Preparación
Preparación de la aleación
Las aleaciones se preparan fundiendo el metal activo (níquel, aunque puede usarse también hierro o cobre) y el aluminio en un crisol, enfriando rápidamente (templando) la mezcla resultante; dicha aleación se muele hasta obtener un polvo muy fino.[2] Dicho polvo puede tamizarse, para obtener una granulometría específica, ya que el tamaño de grano depende de la aplicación.
La composición inicial de la aleación es importante, ya que dependiendo de las proporciones de Ni y Al se forman fases de diferentes propiedades, lo cual se traduce en diferentes porosidades en el producto final. La composición más común contiene un 50% en masa de cada metal, casualmente la proporción que Murray Raney usó cuando descubrió el níquel Raney.
Durante el templado pueden añadirse pequeñas proporciones de metales como el zinc o el cromo, para aumentar la actividad catalítica; a ése metal se le conoce como "promotor".[2] La adición de un tercer metal modifica las propiedades de la aleación y su diagrama de fases, lo que lleva a obtener diferentes propiedades de templado y filtrado del producto. El níquel Raney es pirofórico y debe manejarse con cuidado. Este recipiento está relleno con vermiculita para proteger la botella interior sellada de níquel Raney.
El níquel Raney es pirofórico y debe manejarse con cuidado. Este recipiento está relleno con vermiculita para proteger la botella interior sellada de níquel Raney.
Activación
La estructura porosa del catalizador proviene de la eliminación selectiva del aluminio de la aleación, usando hidróxido de sodio acuoso. La reacción simplificada es:
- 2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
Es necesario usar una disolución muy concentrada de NaOH para poder formar aluminato de sodio (Na[Al(OH)4]) en vez de hidróxido de aluminio, que precipita en forma de bayerita.[2] Así, se usan concentraciones hasta 5 M de NaOH. La bayerita puede bloquear los poros que se intentan formar con esta reacción, disminuyendo por tanto el área superficial del catalizador y reduciendo su eficiencia.
La temperatura a la cual se hace el ataque químico define las propiedades catalíticas del producto; así, el ataque con NaOH se hace a temperaturas que van de 70 a 100ºC. El área superficial del níquel Raney (y de todos los catalizadores porosos en general) tiende a disminuir conforme aumenta la temperatura,[3] debido a reorganizaciones estructurales de la aleación que podrían considerarse análogas a la sinterización, ya que los ligamentos sueltos de dentro de la aleación tienden a unirse unos con otros, disminuyendo el área superficial.
Antes de su almacenamiento, el catalizador puede lavarse con agua destilada, a temperatura ambiente, para eliminar las trazas restantes de aluminato de sodio. Es necesario usar agua sin oxígeno disuelto para prevenir la oxidación del catalizador, ya que dicha oxidación disminuye su eficacia catalítica.[2]
Propiedades
A simple vista, el níquel Raney se presenta como un fino polvo gris. Microscópicamente, cada partícula de catalizador se asemeja a una red tridimensional, con huecos de distintos tamaños y formas, formados en su gran mayoría durante el ataque de la aleación con NaOH. El níquel Raney se caracteriza por ser termoestable y con una gran área superficial. Dichas propiedades son consecuencia directa del proceso de activación y contribuyen a su gran poder catalítico.
Durante la activación, el aluminio se extrae de las fases NiAl3 y Ni2Al3, mientras que la mayor parte de aluminio conservada lo hace en la forma NiAl. El acto de eliminar el aluminio de algunas fases se llama desmetalificación o desaleación selectiva. La fase NiAl le proporciona la estabilidad térmica al catalizador, así, la aleación resultante es bastante resistente a la descomposición (rotura o envejecimiento).[3] Éste hecho permite conservar el níquel Raney durante largos periodos de tiempo, aunque en el laboratorio se prefieren las preparaciones recientes. En el mercado pueden encontrarse las formas "activas" e "inactivas" del catalizador.
El área superficial se determina a través de una medida de adsorción BET, midiendo la cantidad de gas (por ejemplo el hidrógeno) que se adsorbe sobre la superficie. Mediante estas medidas se ha determinado que la gran mayoría del área expuesta contiene átomos de níquel,[2] y ya que el níquel es el metal activo, se concluye que casi toda el área superficial es adecuada para catalizar reacciones, de ahí la alta actividad catalítica que presenta este preparado. El níquel Raney comercial tiene un área superficial de más de 100 m²/g.
Una gran actividad catalítica, unida al hecho de que el hidrógeno se absorbe a través de los poros, hace del níquel Raney un catalizador útil en una gran variedad de reacciones de hidrogenación. Su estabilidad estructural y térmica permite su uso en una gran variedad de condiciones. Además, su solubilidad es despreciable en la gran mayoría de disolventes usados en el laboratorio, con la excepción de los ácidos inorgánicos fuertes, como el ácido clorhídrico, además, su gran densidad (entre 6 y 7 g/cm³) facilita su separación de la fase líquida tras completarse la reacción.
Aplicaciones
El níquel Raney se usa en una gran variedad de procesos industriales y en síntesis orgánicas, gracias a su estabilidad y gran actividad catalítica a temperatura ambiente.[2] [4] Se usa en la reducción de compuestos con enlaces múltiples (insaturados), como alquinos, alquenos,[5] nitrilos,[6] dienos, compuestos aromáticos[7] y carbonilos. Además reduce enlaces heteroatómicos, como el enlace N-O del grupo nitro NO2 y las nitrosaminas.[8] También se usa en la alquilación reductiva de las aminas[9] y en la aminación de los alcoholes.
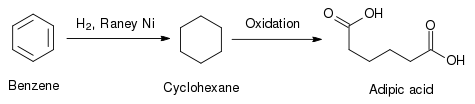
Un ejemplo práctico usado en la industria es la reducción del benceno a ciclohexano. El anillo aromático del benceno es muy estable químicamente, pero el níquel Raney permite hidrogenarlo sin demasiada dificultad. Otros catalizadores heterogéneos, como los elementos del grupo del platino, tienen una actividad parecida, pero comparativamente son mucho más caros que el níquel Raney. Tras esta reducción, el ciclohexano puede usarse en la síntesis del ácido adípico, precursor en la síntesis de poliamidas como el nylon.[10]
En la reducción de un doble enlace C=C (alqueno), el níquel Raney adiciona el hidrógeno con una geometría sin.[10]
Además de su papel como catalizador, el níquel Raney puede usarse como reactivo para desulfurar compuestos orgánicos,[11] como los tioacetales que pueden reducirse a hidrocarburos.[10]
El sulfuro de níquel formado precipita como millerita, mientras que el etano se separa por destilación. Reacciones similares son la reducción de Clemmensen y la de Wolff-Kishner.
Seguridad
Gracias a su gran área superficial y a la gran cantidad de hidrógeno que contiene, el níquel Raney es un agente pirofórico, y debe ser manejado en atmósfera inerte. El níquel Raney se presenta como una dispersión al 50% en agua. Debe evitarse exponer el níquel Raney al aire, ya que, incluso tras usarlo como catalizador, puede presentar cantidades apreciables de hidrógeno adsorbido, y quemarse de forma espontánea.
Cuando quema al aire, se forman gases tóxicos, y debe usarse una mascarilla para extinguirlo. Puede provocar irritaciones del tracto respiratorio, cavidad nasal y fibrosis pulmonar si se inhala. Su ingestión puede dar lugar a trastornos intestinales, además de ser irritante en la piel y los ojos. Su exposición crónica puede desembocar en neumonía y otros síntomas, como hipersensibilidad al níquel.[12]



El níquel se considera como un posible carcinógeno en los humanos, además de ser teratógeno; la inhalación de partículas de óxido de aluminio junto al níquel se asocia con la enfermedad de Shaver. También deben manejarse con cuidado los reactivos usados para prepararlo. Además, la activación del níquel Raney produce grandes cantidades de hidrógeno como subproducto, el cual es altamente inflamable.[12]
Desarrollo
Murray Raney se licenció como Ingeniero Mecánico por la Universidad de Kentucky en 1909. En 1915 se incorporó a la Lookout Oil and Refining Company en Tennessee y fue el responsable de la instalación de las células electrolíticas que se usaban para producir el hidrógeno que luego se usaba en la hidrogenación de aceites vegetales. Durante ese periodo las industrias usaban un catalizador de óxido de níquel (II). Se creía que se podían desarrollar mejores catalizadores, y en 1921 empezó una investigación independiente, mientras seguía trabajando para Lookout Oil. En 1924 produjo una aleación Ni-Si en proporción 1:1, y tras tratarla con NaOH, observó que era cinco veces más activa que el mejor catalizador usado hasta el momento en la hidrogenación del aceite de semilla de algodón. Patentó dicho producto en diciembre de 1925.[13]
Posteriormente Raney fabricó una aleación Ni-Al 1:1 siguiendo un procedimiento similar. Observó que dicho catalizador era incluso más activo que el de Ni-Si y lo patentó en 1926. Es interesante apuntar que la elección del níquel y del aluminio fue puramente fortuita, sin una base científica. Sin embargo, actualmente es la aleación preferida para estos procesos.
Tras el desarrollo del níquel Raney, se han probado otras aleaciones, siendo una de las más notables la formada por cobre, rutenio y cobalto. Investigaciones posteriores han mostrado que la adición de un tercer metal a la aleación binaria aumenta la actividad catalítica. Algunos promotores muy usados son el zinc, el molibdeno y el cromo. Recientemente se ha encontrado la forma de producir níquel Raney enantioselectivo mediante la adsorción de ácido tartárico.[14]
Referencias
- ↑ Raney, Murray (1927). "Method of producing Finely Divided Nickel". US Patent 1628190, issued 1927-05-10.
- ↑ a b c d e f Ertl, Gerhard; Knözinger, Helmut (Eds.) (1997). Preparation of Solid Catalysts, Weinheim: Wiley. ISBN 3-527-29826-6
- ↑ a b A.J. Smith and D.L. Trimm (2005). Annual Reviews in Materials Research, 35, 127-142.
- ↑ Organic Syntheses (2005). Raney nickel usage in Organic Syntheses. Last retrieved January 25, 2006.
- ↑ Page, G. A.; Tarbell, D. S. "ß-(o-Carboxyphenyl)propionic acid" Org. Synth., Coll. Vol. 4, p.136 (1963); Vol. 34, p.8 (1954).
- ↑ Robinson, Jr., H. C.; Snyder, H. R. "ß-Phenylethylamine" Org. Synth., Coll. Vol. 3, p.720 (1955); Vol. 23, p.71 (1943).
- ↑ Schwenk, E.; Papa, D.; Hankin, H.; Ginsberg, H. "?-n-Propylbutyrolactone and ß-(Tetrahydrofuryl)propionic acid" Org. Synth., Coll. Vol. 3, p.742 (1955); Vol. 27, p.68 (1947).
- ↑ Enders, D.; Pieter, R.; Renger, B.; Seebach, D. "Nucleophilic a-sec-aminoalkylation: 2-(diphenylhydroxymethyl)pyrrolidene" Org. Synth., Coll. Vol. 6, p.542 (1988); Vol. 58, p.113 (1978).
- ↑ Rice, R. G.; Kohn, E. J. "N,N'-Diethylbenzidene" Org. Synth., Coll. Vol. 4, p.283 (1963); Vol. 36, p.21 (1956).
- ↑ a b c Solomons, T.W. Graham; Fryhle, Craig B. (2004). Organic Chemistry (8th Edn.), Wiley International Edition. ISBN 0-471-41799-8
- ↑ Gassman, P. G.; van Bergen, T. J. "Indoles from anilines: Ethyl 2-methylindole-5-carboxylate" Org. Synth., Coll. Vol. 6, p.601 (1988); Vol. 56, p.72 (1977).
- ↑ a b Electronic Space Products International (1994). Nickel aluminide MSDS. Last retrieved January 25, 2006.
- ↑ Raney, Murray (1925). "Method of Preparing Catalytic Material". US Patent 1563587, issued 1925-12-01. (Raney's original nickel-silicon catalyst)
- ↑ Bakker, M. L.; Young D. J.; Wainwright, M. S. J. (1988). Mat. Sci. 23, 3921.
Véase también
- Preparación del níquel Raney
- Monzingo, Ralph (1941). "Catalyst, Raney-Nickel, W-2". Org. Synth. 21, 15; Coll. Vol. 3, 181.
- Billica, Harry R.; Adkins, Homer (1949). "Catalyst, Raney-Nickel, W-6". Org. Synth. 29, 24; Coll. Vol. 3, 176.
Enlaces externos
- International Chemical Safety Card 0062
- Guía de bolsillo NIOSH de productos peligrosos
- Monográfico IARC "Níquel y compuestos de níquel"
- Grace Davison - Sitio de Catalizadores Raney. Incluye historia.
Categorías:- Catalizadores
- Aleaciones de níquel
Wikimedia foundation. 2010.