- Óxido de cobre (II)
-
Óxido de cobre (II) 
General Nombre (IUPAC) sistemático Óxido de cobre (II) Otros nombres Óxido cúprico Fórmula molecular CuO Masa molar 79,545 g/mol Aspecto Polvo negro Propiedades[1] Densidad y estado 6,31 g/cm3, sólido Solubilidad en agua Insoluble Solubilidad en Etanol Insoluble Solución acuosa amoniacal Soluble Punto de fusión 1201 °C, 1474 K Punto de ebullición 2000 °C, 2273 K Banda prohibida 1,2 eV Estructura Estructura cristalina monoclínico, mS8[2] Grupo espacial C2/c, #15 Constantes de red a = 4.6837, b = 3.4226
c = 5.1288, β = 99.54Peligros Inflamabilidad No inflamable Compuestos relacionados Otros aniones Sulfuro de cobre (II) Otros cationes Óxido de níquel (II)
Óxido de cincEl óxido de cobre (II) u óxido cúprico (CuO) es el óxido de cobre con mayor número de oxidación. Como mineral se conoce como tenorita.
Contenido
Química
Es un sólido negro con una estructura iónica que funde por encima de 1200 ° C con una cierta pérdida de oxígeno. Puede formarse calentando cobre en presencia de aire:
- 2 Cu + O2 → 2 CuO
Aquí, se forma junto con algo de óxido de cobre (I) como un producto lateral, por lo que es mejor prepararlo por calentamiento de nitrato de cobre (II), hidróxido de cobre (II) o carbonato de cobre (II):
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
- Cu(OH)2 (s) → CuO (s) + H2O (l)
- CuCO3 → CuO + CO2
El óxido de cobre (II) es un óxido básico, así se disuelve en ácidos minerales tales como el ácido clorhídrico, el ácido sulfúrico o el ácido nítrico para dar las correspondientes sales de cobre (II):
- CuO + 2 HNO3 → Cu(NO3)2 + H2O
- CuO + 2 HCl → CuCl2 + H2O
- CuO + H2SO4 → CuSO4 + H2O
Reacciona con álcali concentrado para formar las correspondientes sales cuprato.
- 3 XOH + CuO + H2O → X3[Cu(OH)6]
Puede reducirse a cobre metálico usando hidrógeno o monóxido de carbono:
- CuO + H2 → Cu + H2O
- CuO + CO → Cu + CO2
Un método de laboratorio para preparar óxido de cobre (II) puede ser electrolizar agua conteniendo bicarbonato de sodio a un voltaje moderado con un ánodo de cobre, recoja la mezcla de hidróxido de cobre, carbonato básico de cobre, y carbonato de cobre producida, y caliéntelo.
Estructura del cristal
El óxido de cobre (II) pertenece al sistema monoclínico, con un grupo cristalográfico de 2m o C2h. El grupo espacial de su celda unidad is C2/c, y sus parámetros de red son a = 4.6837(5), b = 3.4226(5), c = 5.1288(6), α = 90° , β = 99.54(1)°, γ = 90°.[2] El átomo de cobre está coordinado por cuatro átomos de oxígeno en una configuración aproximadamente cuadrangular plana.[2]
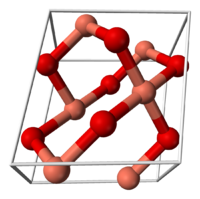
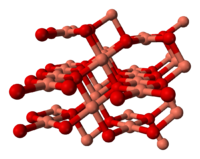
Celda unidad del óxido de cobre (II) Parte de la estructura cristalina del CuO Efectos en la salud
El óxido de cobre (II) es un irritante. También puede causar daño al sistema endocrino y sistema nervioso central. El contacto con los ojos puede causar irritación e importantes daños en la córnea, pudiendo causar conjuntivitis. En contacto con la piel causa irritación y decoloración. La ingestión de polvo de óxido de cobre (II) puede resultar en un sabor metálico, náuseas, vómitos y dolor de estómago. En casos más severos, puede haber sangre en las heces o vómito negro o de color arcilla, ictericia y agrandamiento del hígado. La ruptura de los glóbulos resulta en el colapso circulatorio y shock. La inhalación puede causar daño a los pulmones y el diafragma. La inhalación de vapores durante la fusión de polvo de óxido cúprico puede conducir a una enfermedad llamada la fiebre de humo metálico, que puede causar síntomas de tipo gripal. El óxido de cobre (II) puede causar una acumulación tóxica de cobre en un pequeño subconjunto de la población con enfermedad de Wilson. La manipulación de polvo de óxido de cobre (II) debe hacerse en un área bien ventilada, y se debe tener cuidado para evitar el contacto con la piel o los ojos.[3] Sin embargo, el cobre es un oligoelemento esencial para la función normal de muchos tejidos, incluyendo el sistema nervioso, el sistema inmunitario, el corazón, la piel y para la formación de capilares[4] [5] así como el cobre, siendo sumamente bien metabolizado por los seres humanos. El óxido de cobre se utiliza en suplementos vitamínicos como una fuente segura de cobre[6] y tratamientos sin receta médica. El óxido de cobre también es usado en productos de consumo como fundas de almohada y calcetines, debido a sus propiedades cosméticas y antimicrobianas.[7] [8] [9] [10] El riesgo de sensibilidad dérmica frente al cobre es considerado sumamente pequeño.[11]
Usos
El óxido cúprico se utiliza como pigmento en cerámica para producir esmaltes azul, rojo y verde (y a veces gris, rosa o negro). También se utiliza para producir soluciones de hidróxido de cupramonio, usado para fabricar rayón. También se utiliza ocasionalmente como suplemento dietético en animales con deficiencia de cobre.[12] El óxido de Cobre (II) tiene aplicación como un semiconductor tipo p, porque tiene una banda prohibida estrecha, de 1,2 eV. Se trata de un abrasivo usado para pulir los equipos ópticos. El óxido cúprico puede ser usado para producir pilas secas. También se ha utilizado en pilas húmedas como cátodo, con litio como ánodo, y dioxalano mezclado con perclorato de litio como electrolito. El óxido de cobre (II) puede utilizarse para producir otras sales de cobre. También se utiliza cuando se suelda con aleaciones de cobre.[13]
Otro uso para el óxido de cobre es como sustituto para el óxido de hierro en la termita. Esto puede cambiar la termita de incendiaria a un bajo explosivo.
Uso en eliminación de sustancias
El óxido cúprico puede ser usado para eliminar en forma segura materiales peligrosos tales como cianuro, hidrocarburos, hidrocarburos halogenados y dioxinas, a través de oxidación.[14]
Aquí están las ecuaciones que representan la descomposición del fenol y el pentaclorofenol, respectivamente, con óxido de cobre:
- C6H5OH + 14 CuO → 6 CO2 + 3 H2O + 14 Cu
- C6Cl5OH + 2 H2O + 9 CuO → 6 CO2 + 5 HCl + 9 Cu
Propiedades
- Función trabajo: 5.3 eV.[15]
Véase también
Referencias
- ↑ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ↑ a b c The effect of hydrostatic pressure on the ambient temperature structure of CuO, Forsyth J.B., Hull S., J. Phys.: Condens. Matter 3 (1991) 5257-5261 , doi 10.1088/0953-8984/3/28/001
- ↑ «Material safety data sheet: Copper (II) oxide». Iowa State University (2003). Consultado el 26-01-2007.
- ↑ Uauy et al (1998). «Essentiality of copper in humans». Am J Clin Nutr 67: pp. 952S-9S. http://www.ajcn.org/cgi/content/abstract/67/5/952S.
- ↑ Sen et al (2002). «Copper-induced vascular endothelial growth factor expression and wound healing.». Am J Physiol Heart Circ Physiol 282: pp. H1821-27. http://ajpheart.physiology.org/cgi/content/abstract/282/5/H1821.
- ↑ «Vitamin Supplements:».
- ↑ Borkow G, et al. (2009). «Improvement of facial skin characteristics using copper oxide containing pillowcases: a double-blind, placebo-controlled, parallel, randomized study». Int J Cosmet Sci 31(6): pp. 437-43. PMID 19467028.
- ↑ Borkow G, et al. (2009). «Reducing the risk of skin pathologies in diabetics by using copper impregnated socks.». Med Hypotheses 73(6): pp. 883-6. PMID 19559540.
- ↑ Borkow G, et al. (2005). «Copper as a biocidal tool.». Curr Med Chem 12(18): pp. 2163-75. PMID 16101497.
- ↑ Borkow G, et al. (2004). «Copper-impregnated products with potent biocidal activities.». FASEB J. 18(14): pp. 1728-30. PMID 15345689.
- ↑ Hostynek JJ, and Maibach HI (2003). «hypersensitivity: dermatologic aspects-an overview». Rev Environ Health 153: pp. 153–83. PMID 14672513.
- ↑ «Uses of Copper Compounds: Other Copper Compounds». Copper Development Association (2007). Consultado el 27-01-2007.
- ↑ «Cupric Oxide Data Sheet». Hummel Croton Inc. (21-04-2006). Consultado el 01-02-2007.
- ↑ Use of copper (II) oxide as source of oxygen for oxidation reactions. April. http://www.freepatentsonline.com/4582613.html. Consultado el 2007-06-29.
- ↑ F. P. Koffyberg and F. A. Benko (1982). «A photoelectrochemical determination of the position of the conduction and valence band edges of p-type CuO». J. Appl. Phys. 53: p. 1173. doi:.
- Este artículo fue creado a partir de la traducción del artículo Copper(II) oxide de la Wikipedia en inglés, bajo licencia Creative Commons Atribución Compartir Igual 3.0 y GFDL.
Enlaces externos
Categorías:- Óxidos
- Compuestos de cobre
- Materiales semiconductores
- Colorantes pirotécnicos
Wikimedia foundation. 2010.
