- Piperidina
-
Piperidina
PiperidinaNombre (IUPAC) sistemático n/d General Fórmula molecular n/d Identificadores Número CAS n/d Propiedades físicas Densidad n/d Masa molar n/d Punto de fusión K (-273,15 °C) Punto de ebullición K (-273,15 °C) Propiedades químicas Solubilidad en agua n/d Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasPiperidinaes un compuesto organico de fórmula molecular (CH2)5NH. Esta amina heterocíclica consiste de un anillo de seis miembros que contienen cinco metilenos un átomo de nitrógeno. Es un líquido incoloro y fumante cuyo olor se describe como amoniacal, similar a la pimienta;[1] el nombre proviene de la palabra pimienta.[2] La piperidina es ampliamente usada en la síntesis de compuestos orgánicos, incluidos los farmacéuticos.
Contenido
Producción
Industrialmente, la Piperidina es producida por hidrogenación de la Piridina, usualmente catalizado por disulfuro de molibdeno:[3]
- C5H5N + 3 H2 → C5H10NH
La Piridina tambien puede ser reducida a Piperidina por sodio en etanol.[4]
Disponibilidad natural de Piperidina y sus derivados
La Piperidina ha sido obtenida desde la pimienta[5] , de las variedades naturales Psilocaulon absimile N.E.Br (Aizoaceae)[6] , y Petrosimonia monandra.[7]
El motivo estructural de la Piperidina se encuentra en numerosos alcaloides naturales. Entre estos se incluyen la Piperina, que da a la pimienta negra su sabor picante. A esto se debe el nombre del compuesto. Otros ejemplos son la toxina de las hormigas coloradas Solenopsin [8] , el análogo de la nicotina, la anabasina del arbol de tabaco (Nicotiana glauca), lobelina del tabaco indio, el alcaloide toxico coniina del género de plantas Conium</ref>.
Conformación
La Piperidina prefiere la conformación de sillan, similar al ciclohexano. A diferencia del ciclohexano, la Piperidina tiene dos conformaciones de silla distinguibles: unacon el enlace N–H en posición axial, y la otra en posición ecuatorial. Luego de mucha controversia durante los años 1950–1970, se encontró que la conformacion ecuatorial era mas estable por 0.72 kcal/mol en la fase gaseosa.[9] En volventes no polares, se estimó un rango entre 0.2 y 0.6 kcal/, pero en solventes polares la conformación axial puede que sea mas estable.[10] Los dos confórmeros se interconvierten rápitamente a traves de la inversión del Nitrógeno; la barrera de activación de la energia libre para este proceso se estima en 6.1 kcal/mol, es sustancialmente mas baja que los 10.4 kcal/mol de la inversión del anillo.[11] En el caso de la N-metilpiperidina, la conformación ecuatorial es la preferida por 3.16 kcal/mol,[9] que es mucho mayor que la preferencia en el metilciclohexano, con solo 1.74 kcal/mol.
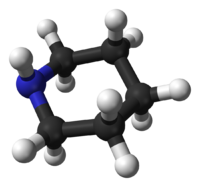
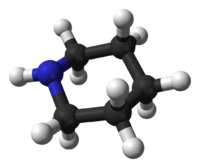
Conformación axial Conformación ecuatorial Reacciones
La Piperidina es una ampliamente usada amina secundaria. Se usa para convertir cetonas en enaminas.[12] Las Enaminas que derivan de la Piperidina pueden ser usadas en la Alquilacion de enaminas de Stokes.[13]
La Piperidina puede ser convertida en la cloramina C5H10NCl con hipoclorito de calcio. La cloramina resultante sufre dehidrohalogenación para dar una imina cíclica.[14]
Usos
La Piperidina es usada como solventea y como base. Lo mismo sucede con algunos derivados: La solvente polar aprótico con mejor solubilidad de hidrocarburos que otras aminas solventes, y la 2,2,6,6-tetrametilpiperidina es una base muy útil debido a su baja nucleofilicidad y alta solubilidad en solventes orgánicos.
La piperidina y sus derivados son muy usados en la síntesis de compustos farmacéuticos. La piperidina es encontrada en las fórmulas farmacéuticas paroxetina, risperidona, metilfenidato, raloxifena, minoxidil, tioridazina, haloperidol, droperidol, mesoridazina, meperidina, melperona los agentes psicoquímicosDitran-B (JB-329), N-metil-3-piperidil benzilato (JB-336) y muchos otros.
La piperidina es comunmente usada en reacciones químicas de degradación, como la secuenciación de ADN in en el clivaje de algunos nucleótidos particularmente modificados.
La Piperidina esta listada en la Tabla II como precursor bajo la Convencion de las Naciones Unidas Contra el Trafico Ilìcito de Drogas Narcóticas y Sustancias Psicotrópicas debido a su uso en los años 70 en la industria clandestina de PCP (también conocido como polvo de angel).[15]
References
- ↑ Frank Johnson Welcher (1947). Organic Analytical Reagents. D. Van Nostrand, pp. 149.
- ↑ Alexander Senning (2006). Elsevier's Dictionary of Chemoetymology. Amsterdam: ElsevierElsevier. ISBN 0444522395.
- ↑ Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke “Amines, Aliphatic” Ullmann's Encyclopedia of Industrial Chemistry 2002 Wiley-VCH. DOI 10.1002/14356007.a02_001
- ↑ C. S. Marvel and W. A. Lazier (1941). "Benzoyl Piperidine". Org. Synth.; Coll. Vol. 1: 99.
- ↑ Spaeth and Englaender, Ber.1935,68, 2218; cf. Pictet and Pictet, Helv. Chim. Acta, 1927, 10, 593
- ↑ Rimington, S. Afr. J. Sci, 1934, 31, 184
- ↑ Juraschewski and Stepanov, J. Gen. Chem., U.R.S.S., 1939, 9, 1687
- ↑ Arbiser JL, Kau T, Konar M et al. (2007). «Solenopsin, the alkaloidal component of the fire ant (Solenopsis invicta), is a naturally occurring inhibitor of phosphatidylinositol-3-kinase signaling and angiogenesis» Blood. Vol. 109. n.º 2. pp. 560–5. DOI 10.1182/blood-2006-06-029934. PMID 16990598.
- ↑ a b Luis Carballeira, Ignacio Pérez-Juste (1998). «Influence of calculation level and effect of methylation on axial/equatorial equilibria in piperidines» Journal of Computational Chemistry. Vol. 19. n.º 8. pp. 961–976. DOI <961::AID-JCC14>3.0.CO;2-A 10.1002/(SICI)1096-987X(199806)19:8<961::AID-JCC14>3.0.CO;2-A.
- ↑ Ian D. Blackburne, Alan R. Katritzky, Yoshito Takeuchi (1975). «Conformation of piperidine and of derivatives with additional ring hetero atoms» Acc. Chem. Res.. Vol. 8. n.º 9. pp. 300–306. DOI 10.1021/ar50093a003.
- ↑ F.A.L. Anet, Issa Yavari (1977). «Nitrogen inversion in piperidine» J. Am. Chem. Soc.. Vol. 99. n.º 8. pp. 2794–2796. DOI 10.1021/ja00450a064.
- ↑ Vinayak V. Kane and Maitland Jones Jr (1990). "Spiro[5.7]trideca-1,4-dien-3-one". Org. Synth.; Coll. Vol. 7: 473.
- ↑ March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure Michael B. Smith, Jerry March Wiley-Interscience, 5th edition, 2001, ISBN 0-471-58589-0
- ↑ George P. Claxton, Lloyd Allen, and J. Martin Grisar (1988). "2,3,4,5-Tetrahydropyridine trimer". Org. Synth.; Coll. Vol. 6: 968.
- ↑ List of Precursors and Chemicals Frequently Used in the Illicit Manufacture of Narcotic Drugs and Psychotropic Substances Under International Control, International Narcotics Control Board
Categorías: Compuestos heterocíclicos | Aminas
Wikimedia foundation. 2010.
