- Resistencia a antibióticos
-
La resistencia antibiótica es la capacidad de un microorganismo para resistir los efectos de un antibiótico. La resistencia se produce naturalmente por selección natural a través de mutaciones producidas por azar, pero también puede inducirse artificialmente mediante la aplicación de una presión selectiva a una población. Una vez que se genera la información genética, las bacterias pueden transmitirse los nuevos genes a través de trasferencia horizontal (entre individuos) por intercambio de plásmidos. Si una bacteria porta varios genes de resistencia, se le denomina multirresistente o, informalmente, superbacteria.
La resistencia a los antibóticos es un problema de salud pública mundial.[1]
Contenido
Causas
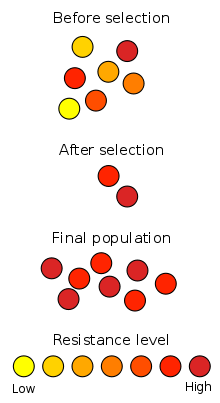 Representación esquemática de cómo la resistencia antibiótica se origina a través de selección natural. La sección superior representa una población de bacterias antes de su exposición a un antibiótico. La sección intermedia muestra la población justo después de la exposición, la fase en la que tiene lugar la selección. La sección inferior muestra la distribución de la resistencia en la nueva generación de bacterias. Los colores indican el nivel de resistencia de cada bacteria.
Representación esquemática de cómo la resistencia antibiótica se origina a través de selección natural. La sección superior representa una población de bacterias antes de su exposición a un antibiótico. La sección intermedia muestra la población justo después de la exposición, la fase en la que tiene lugar la selección. La sección inferior muestra la distribución de la resistencia en la nueva generación de bacterias. Los colores indican el nivel de resistencia de cada bacteria.
La resistencia antibiótica es una consecuencia de la evolución vía la selección natural. La acción antibiótica es una presión ambiental: aquellas bacterias que tengan una mutación que les permita sobrevivir se reproducirán. Ellas pasarán este rasgo a su descendencia, que será una generación totalmente resistente.[2]
Varios estudios han demostrado que ciertos patrones de uso de los antibióticos afectan en gran medida al número de organismos resistentes que se desarrollan. El uso excesivo de antibióticos de amplio espectro, tales como las cefalosporinas de segunda y tercera generación, acelera en gran medida el desarrollo de resistencia a la meticilina. Otros factores que contribuyen a la resistencia incluyen los diagnósticos incorrectos, prescripciones innecesarias, uso incorrecto de antibióticos por parte de los pacientes y el uso de los antibióticos como aditivos en la alimentación del ganado para aumentar el engorde.[3]
Investigaciones recientes han demostrado que la proteína bacteriana LexA puede jugar un papel fundamental en la adquisición de mutaciones bacterianas.[4]
La resistencia bacterial a antibióticos no es un fenómeno nuevo. La innovación en el arsenal químico disponible para el control de infecciones se viene dando desde 1945 cuando se reportó la primera evidencia de resistencia a la penicilina, el llamado «medicamento que ganó la 2ª Guerra Mundial». Después de 1945 se han desarrollado varios grupos de antibióticos derivados de las moléculas originales en los cuales se hacen cambios en la estructura química de la molécula original sin hacer cambios en el sitio activo de la misma. Esto ha traído las llamadas generaciones de antibióticos, llegándose a tener cuatro generaciones de penicilinas y cefalosporinas, tres generaciones de antibióticos macrólidos e innumerable cantidad de moléculas antibióticas que se volvieron obsoletas. Estos datos reales son testimonio de cuán capaces son las bacterias de desarrollar resistencia a los antibióticos impulsadas por la presión evolutiva que el arsenal químico de la humanidad ha impuesto sobre ellas.
Para efecto práctico, un antibiótico empieza a perder vigencia en el mismo momento en que es usado de forma masiva, ya que esto impone una nueva presión evolutiva a organismos con un tiempo de vida generacional muy corto (alrededor de 20 minutos) con frecuencias de mutación genética que ronda 1 en 10 millones. En cuestión de años estas mutaciones genéticas pueden codificar para la síntesis de proteínas que eventualmente ayudan a la bacteria a contrarrestar el efecto de un antibiótico sobre ella (como la enzima NDM-1, capaz de degradar antibióticos).[5]
El tiempo en que tal resistencia se pone de manifiesto es muy variable, habiendo casos de 1 año, como en el caso de la Penicilina V, y 30 años como en el caso de la Vancomicina. Esta variabilidad refleja cuán complejo puede ser el mecanismo de desarrollo de resistencia a antibióticos por parte de las bacterias.[6]
Patógenos resistentes
Staphylococcus aureus es uno de los principales patógenos resistentes a los antibióticos. Se encuentra en las mucosas y en la piel de aproximadamente la mitad de la población y es extremadamente adaptable a la presión antibiótica. Fue la primera bacteria en la que se descubrió la resistencia a la penicilina en 1947, solo cuatro años después de que comenzase su producción en masa. La meticilina era entonces el antibiótico alternativo, pero desde entonces ha sido reemplazado por la oxacilina debido a su importante toxicidad renal. El primer MRSA (Staphylococcus aureus resistente a la meticilina) fue inicialmente detectado en Inglaterra en 1961 y es ahora bastante común en los hospitales. MRSA fue responsable del 37% de los casos locales de sepsis en Inglaterra en 1999, y hasta un 4% en 1991. La mitad de todas las infecciones de S. aureus en EE.UU. son resistentes a penicilina, meticilina, tetraciclina y eritromicina.
Esto deja a la vancomicina como el único medicamento efectivo disponible actualmente. Sin embargo, a finales de la década de 1990 aparecieron las primeras cepas con niveles intermedios de resistencia (4-8 ug/ml), a los que se denomina GISA (Staphylococcus aureus intermedio al glicopéptido) o VISA (Staphylococcus aureus intermedio a la vancomicina). El primer caso identificado se produjo en Japón en 1996, y desde entonces la cepa se ha encontrado en hospitales en Inglaterra, Francia y EE.UU. La primera cepa documentada con resistencia total a la vancomicina (>16ug/ml), denominada VRSA (Staphylococcus aureus resistente a la vancomicina) hizo su aparición en EE.UU. en 2002.
Una nueva clase de antibióticos, las oxazolidinonas, ha comenzado a estar disponible en la década de 1990, siendo la linezolida la primera oxazolidinona disponible comercialmente, comparable en eficiencia a la vancomicina contra MRSA. Sin embargo, se ha informado de Staphylococcus aureus resistente a la linezolida en 2003.
Actualmente, CA-MRSA (MRSA adquirida en comunidades) se ha convertido en una enfermedad epidémica de rápida evolución y desenlace fatal, que incluye neumonía necrotizante, sepsis grave y fascitis necrotizante.[7] MRSA es el patógeno resistente a los antibióticos más frecuentemente identificado en los hospitales de EE.UU. La epidemiología de las infecciones causadas por MRSA en los últimos 10 años ha cambiado rápidamente a CA-MRSA. Las dos cepas de MRSA implicadas en los brotes en comunidades, USA400 (cepa MW2, línea ST1) y USA300, a menudo presentan genes Panton-Valentine leucocidina (PVL) y frecuentemente están asociados a infecciones de la piel y de los tejidos blancos. Se han producido brotes de infecciones CA-MRSA en correccionales, equipos de deportistas, personal del ejército, guarderías y en homosexuales activos. Las infecciones por CA-MRSA son actualmente endémicas en muchas regiones urbanas siendo responsables de la mayoría de las infecciones CA-S. aureus.[8]
Enterococcus faecium es otra bacteria resistente a los antibióticos presente en los hospitales. Cepas resistentes a la penicilina fueron identificadas en 1983, resistentes a la vancomicina (VRE) en 1987 y resistentes a la linezolida (LRE) a finales de la década de 1990.
Streptococcus pyogenes (Streptococcus del Grupo A: GAS) causa infecciones que pueden tratarse usualmente con una gran variedad de antibióticos. Pero incluso la mejor atención médica no impide la enfermedad invasiva y la muerte en todos los casos. Para aquellos enfermos muy graves, puede ser necesario el apoyo de una unidad de cuidados intensivos. Para personas con fascitis necrotizante se precisa a menudo cirugía para eliminar los tejidos dañados.[9] Se han descubierto cepas de S. pyogenes resistentes a los antibióticos macrólidos; sin embargo, todas las cepas continúan siendo uniformemente sensibles a la penicilina.[10]
La resistencia de Streptococcus pneumoniae a la penicilina y a otros beta-lactamos se está incrementando en todo el mundo. El principal mecanismo de resistencia envuelve la introducción de mutaciones en los genes que codifican las proteínas de enlace de la penicilina. La presión selectiva juega un papel importante y el uso de antibióticos beta-lactamos se cita como un factor de riego para la infección y colonización. Streptococcus pneumoniae es responsable de neumonía, bacteremia, otitis media, meningitis, sinusitis, peritonitis y artritis.[10]
Proteus puede producir infecciones del tracto urinario e infecciones adquiridas en hospitales. Proteus es única, sin embargo, porque es altamente móvil y no forma colonias regulares. En su lugar, Proteus forma lo que se conoce como "colonias enjambres" cuando se colocan en medios no inhibidores. El miembro más importente de este género es Proteus mirabilis, causante de infecciones urinarias y de las heridas. Afortunadamente, la mayoría de las cepas de Proteus mirabilis son sensibles a la ampicilina y a las cefalosporinas. Al contrario, su pariente Proteus vulgaris, no es sensible a esos antibióticos. Sin embargo, este organismo es aislado menos frecuentemente en el laboratorio y usualmente solo ataca a pacientes inmunodeprimidos. Proteus vulgaris se encuentra naturalmente en el intestino de las personas y en una gran variedad de animales; estiercol, suelos y aguas contaminadas. Más del 80% de las infecciones del tracto urinario (UTI) son causadas por la bacteria Escherichia coli pero las infecciones urinarias causadas por Proteus mirabilis están también bien documentadas. Proteus mirabilis una vez establecido en el tracto urinario, infecta el riñon más frecuentemente que E. coli. Proteus mirabilis es una bacteria Gram-negativa móvil perteneciente a la familia Enterobacteriaceae, pero también parasita el tracto urinario superior de los seres humanos.
La neumonía causada por Streptococcus pneumoniae resistente a la penicilina (comúnmente conocido como pneumococcus) fue detectada inicialmente en 1967, al igual que la gonorrea resistente a la penicilina. También S. aureus ha presentado resistencia a las alternativas a la penicilina. En 1993, Escherichia coli era resistente a cinco variantes de las fluoroquinolonas. Mycobacterium tuberculosis es comúnmente resistente a la isoniazida y rifampicina y algunas veces universalmente resistente a todos los tratamientos comunes. Otros patógenos que presentan alguna resistencia incluyen a Salmonella, Campylobacter y Streptococcus.
Pseudomonas aeruginosa es un relevante patógeno oportunista causante de infecciones crónicas. Una de las características más preocupantes de P. aeruginosa es que presenta una baja susceptibilidad antibiótica. Esta baja susceptibilidad es debida a la acción concertada de un bombeo multidroga al exterior, genes en los cromosomas que codifican la resistencia antibótica y la baja permeabilidad de la envoltura celular bacteriana. Además de esta resistencia intrínseca, P. aeruginosa desarrolla fácilmente una resistencia adquirida por mutaciones en los genes cromosómicos o por transferencia horizontal de genes. El agrupamiento de varios genes de resistencia a los antibióticos en integrones favorece la adquisición concertada de los factores determinates a la resistencia antibiótica. Algunos estudios recientes muestran que los fenotipos de resistencia asociados a la formación de biopelículas o a la aparición de pequeñas variantes en las colinias puede ser importante para la respuesta de las poblaciones de P. aeruginosaal tratamiento antibiótico.[11]
Papel de los animales
Staphylococcus aureus resistente a la meticilina (MRSA) es reconocido como un comensal y patógeno de los seres humanos. MRSA también se ha encontrado en gatos, perros y caballos, donde puede causar las mismas enfermedades que en los humanos. Sus amos pueden transferir la bacteria a sus mascotas y viceversa. Se cree que el MRSA de los animales se deriva del de los humanos.[12]
Actualmente se estima que más del 70% en volumen de los antibióticos producidos en EE.UU. se usa en alimentación animal (pollos, cerdos y vacas) en ausencia de enfermedad. El uso de algunos antibióticos en la alimentación animal se ha asociado con la emergencia de cepas de bacterias resistentes a los antibióticos, incluyendo Salmonella, Campylobacter, Escherichia coli y Enterococcus, entre otros. Existen pruebas sólidas en EE.UU. y en la Unión Europea de que esas bacterias resistentes causan infecciones resistentes a los antibióticos en los seres humanos. La Asociación Estadounidense de Microbiología (ASM), la Asociación Estadounidense de Salud Pública (APHA) y la Asociación Médica Estadounidense (AMA) han solicitado restricciones en el uso de los antibióticos en la alimentación animal, incluyendo la supresión de todos los usos no terapeúticos. Las industrias de alimentación animal y farmacéuticas han presionado duramente para evitar estas regulaciones. Por ejemplo, en 2000 la Administración de Alimentos y Medicamentos de EE.UU. (FDA) anunció su intención de revocar la autorización del uso de la fluoroquinolona en la producción avícola puesto que se había comprobado que causó la aparición de infecciones de Campylobacter resistentes a la fluoroquinolona en seres humanos. La decisión final de la prohibición del uso de las fluoroquinolonas en la producción avícola no se produjo hasta cinco años más tarde por los trucos legales de las industrias de alimentación animal y farmacéuticas.[13] Actualmente, en EE.UU. hay dos leyes federales (S.742 y H.R. 2562) encaminadas a la eliminación de los usos no terapeúticos de los antibióticos en la alimentación animal. Estas leyes están respaldadas por la mayoría de las organizaciones médicas y de salud pública, incluyendo la Asociación Estadounidense de Enfermeras (ANA), la Academia Estadounidense de Pediatría (AAP) y la Asociación Estadounidense de Salud Pública (APHA).
Alternativas
Prevención
Lavarse las manos adecuadamente reduce la posibilidad de infección o de propagar infecciones. Lavar a fondo o evitar manipular a la vez los alimentos crudos como frutas, verduras, huevos crudos y carne poco cocinada con alimentos cocinados también puede reducir la posibilidad de una infección. Actividades de alto riego incluyen: sexo sin protección,[14] [15] [16] uso de equipamiento en gimnasios o lugares públicos, ser un paciente en un hospital o en una residencia de ancianos, ser un recluso, ir a la peluquería, compartir productos personales (cosméticos, lociones, ropa de cama, pasta de dientes, auriculares, tijeras de uñas, champú).
Evitar el uso de antibióticos, en algunas situaciones, también puede reducir la posibilidad de infección por bacterias resistentes a los antibióticos. Un estudio determinó que el uso de fluoroquinolonas estaba claramente asociado con la infección por Clostridium difficile, que es una de las principales causas de diarrea nosocomial en EE.UU.[17] y una importante causa de muerte en todo el mundo.[18]
Las vacunas no sufren el problema de la resistencia porque éstas aumentan las defensas naturales del cuerpo, mientras que los antibióticos operan de forma separada a las defensas normales del cuerpo. Esto no excluye que las nuevas cepas puedan escapar a la inmunidad inducida por las vacunas.
Aunque teóricamente prometedoras, las vacunas anti-Staphylococcus han demostrado escasa eficacia debido a la variación inmunológica entre las distintas especies de Staphylococcus y a la duración limitada de la efectividad de los anticuerpos producidos. Actualmente está en curso el desarrollo y prueba de vacunas más efectivas.
Terapia fágica
La terapia fágica, una aproximación que ha sido extensivamente investigada y utilizada como agente terapéutico durante 60 años, especialmente en la Unión Soviética, es una alternativa que debería ayudar al problema de la resistencia. La terapia fágica fue extensamente utilizada en EE.UU. hasta el descubrimiento de los antibióticos a comienzo de la década de 1940. Los bacteriófagos o "fagos" son virus que invaden las células bacterianas y, en el caso de los fagos líticos, interrumpen el metabolismo bacteriano y producen la lisis de la bacteria. La terapia fágica es el uso terapéutico de los bacteriófagos líticos para tratar las infecciones causadas por bacterias patógenas.[19] [20] [21]
La terapia fágica es una importante alternativa en la era actual de bacterias multirresistentes a los antibióticos.[22] [23] Los fagos han sido usados tópicamente, oralmente o sistémicamente en Polonia y en la Unión Soviética con una tasa de éxito del 80-95% con pocos efectos colaterales gastrointestinales o alérgicos. Estudios ingleses también han demostrado la eficacia de los fagos contra Escherichia coli, Acinetobacter, Pseudomonas y Staphylococcus aureus. Los estudios realizados en EE.UU. se centran en la mejora de la biodisponibidad del fago.
Desarrollo de nuevos antibióticos
Hasta recientemente, los esfuerzos de investigación y desarrollo (I+D) han proporcionado a tiempo nuevos medicamentos para tratar a las bacterias que se han hecho resistentes a los antibióticos antiguos. Esto actualmente ya no es así. La potencial crisis es el resultado de la disminución de los presupuestos de I+D en la industria, la inactividad del gobierno y el incremento de la prevalencia de las bacterias resistentes. Los médicos que tratan las enfermedades infecciosas está preocupados por la perspectiva de no disponer de antibióticos eficaces para tratar a pacientes gravemente enfermos en un futuro próximo.
La investigación en nuevos antibióticos está casi parada. Las principales empresas farmacéuticas están perdiendo interés en los antibióticos porque no dan tantos beneficios como los medicamentos que tratan las enfermedades crónicas (de larga duración) y las relacionadas con el estilo de vida.[24]
El problema de la resistencia demanda que se haga un renovado esfuerzo para buscar agentes antibacterios efectivos contra las bacterias patógenas resistentes a los antibióticos actuales. Una de las posibles estrategias hacia este objetivo es una búsqueda racional de fitoquímicos bioactivos. Las plantas tienen una habilidad casi sin límites de sintetizar sustancias aromáticas, la mayoría de las cuales son fenoles, o sus derivados por sustitución del oxígeno tales como taninos. La mayoría son metabolitos secundarios, de los cuales se han aislado al menos 12.000, un número que se estima que es menor al 10% del total. En muchos casos, estas sustancias le sirven a la planta como mecanismos de defensa contra la predación por parte de microorganismos, insectos y herbívoros. Muchas de las hierbas y especias usadas por los humanos para sazonar la comida contienen componentes medicinales, incluyendo algunos que tienen actividad antibacteriana.[25] [26] [27]
Los curanderos tradicionales han utilizado desde hace mucho tiempo plantas para prevenir o curar enfermedades infecciosas. Muchas de esas plantas han sido investigadas científicamente en busca de actividad antimicrobiana y se ha probado que un gran número de compuestos vegetales inhiben el crecimiento de las bacterias patógenas. Un cierto número de esos agentes parece que tienen estructuras y modos de acción distintos a los de los antibióticos en uso, sugiriendo que la resistencia cruzada con éstos será mínima. Por ejemplo, la combinación de 5'-metoxihidnocarpina y berberina en hierbas como Hydrastis canadensis y Berberis vulgaris puede bloquear el bombeo activo de MDR que causa la resistencia multimedicamento. Esto ha sido probado para Staphylococcus aureus.[28]
Aplicaciones en selección genética
La resistencia antibiótica es una herramienta importante en ingeniería genética. Elaborando un plásmido que contenga un gen de resistencia antibiótica además del gen de interés, permite que al tratar los cultivos bacterianos con el antibiótico correspondiente, sólo prosperen las copias de las bacterias que llevan los genes insertados.
Los antibióticos más comúnmente utilizados en ingeniería genética son generalmente los antibióticos más antiguos que han fallado hace tiempo en la práctica clínica. Estos incluyen:
El uso industrial de la resistencia antibiótica es desaconsejable puesto que el mantenimiento de los cultivos bacterianos requeriría el uso de grandes cantidades de antibióticos. En vez de ello, se prefiere el uso de cepas de bacterias auxotróficas (y una función de reemplazamiento de plásmidos).
Véase también
- Prevención cuaternaria
- Betalactamasa
- Ampicilina/sulbactam
Referencias
- ↑ Gérvas J. La resistencia a los antibióticos, un problema de salud pública. Aten Primaria. 2000; 25(8):589-96.
- ↑ Pastor-Sánchez R. Alteraciones del nicho ecológico. Resistencias bacterianas a los antibióticos. Gac Sanit. 2006; 20(Supl 1):175-81.
- ↑ Baos V, Barbero A, Diogène E, Eguilleor A, Eyaralar T, Ibañez J, Mediavilla A, Mora I, Palop V, Pastor Sánchez R, et al. Documento de consenso sobre la utilización de antibióticos en atención primaria. Aten Primaria. 2006;38(3):174-7.
- ↑ Cirz RT, Chin JK, Andes DR, de Crécy-Lagard V, Craig WA, Romesberg FE (2005). «Inhibition of mutation and combating the evolution of antibiotic resistance». PLoS Biol. 3 (6): pp. e176. doi:. PMID 15869329. http://biology.plosjournals.org/perlserv/?request=get-document&doi=10.1371/journal.pbio.0030176.
- ↑ «Descifran enzima que hace a bacterias resistentes a antibióticos». La Jornada (6 de septiembre de 2011). Consultado el 7 de septiembre de 2011.
- ↑ Walsh, C.; Wright, G. (2005). «Introduction: Antibiotic Resistance». Chem. Rev. 105 (2): pp. 391. doi:. http://http://pubs.acs.org/doi/full/10.1021/cr030100y.
- ↑ Boyle-Vavra S, Daum RS (2007). «Community-acquired methicillin-resistant Staphylococcus aureus: the role of Panton-Valentine leukocidin». Lab. Invest. 87 (1): pp. 3-9. doi:. PMID 17146447.
- ↑ Maree CL, Daum RS, Boyle-Vavra S, Matayoshi K, Miller LG (2007). «Community-associated methicillin-resistant Staphylococcus aureus isolates causing healthcare-associated infections». Emerging Infect. Dis. 13 (2): pp. 236-42. PMID 17479885. http://www.cdc.gov/eid/content/13/2/236.htm?s_cid=eid236_e.
- ↑ Division of Bacterial and Mycotic Diseases (October 11, 2005). «Group A Streptococcal (GAS) Disease (strep throat, necrotizing fasciitis, impetigo) -- Frequently Asked Questions». Centers for Disease Control and Prevention. Consultado el 11-12-2007.
- ↑ a b Albrich WC, Monnet DL, Harbarth S (2004). «Antibiotic selection pressure and resistance in Streptococcus pneumoniae and Streptococcus pyogenes». Emerging Infect. Dis. 10 (3): pp. 514-7. PMID 15109426. http://www.cdc.gov/ncidod/eid/vol10no3/03-0252.htm.
- ↑ Cornelis P (editor). (2008). Pseudomonas: Genomics and Molecular Biology (1st ed. edición). Caister Academic Press. ISBN [[Especial:FuentesDeLibros/978-1-904455-19-6 ]|978-1-904455-19-6 ]]]. http://www.horizonpress.com/pseudo.
- ↑ Soulsby EJ (2005). «Resistance to antimicrobials in humans and animals». BMJ 331 (7527): pp. 1219-20. doi:. PMID 16308360. http://www.bmj.com/cgi/content/full/331/7527/1219.
- ↑ Nelson JM, Chiller TM, Powers JH, Angulo FJ (2007). «Fluoroquinolone-resistant Campylobacter species and the withdrawal of fluoroquinolones from use in poultry: A public health success story». Clin Infect Dis 44: pp. 977–80. http://www.journals.uchicago.edu/CID/journal/issues/v44n7/41120/41120.html.
- ↑ «Resurgent bacterial sexually transmitted disease among men who have sex with men--King County, Washington, 1997-1999». MMWR Morb. Mortal. Wkly. Rep. 48 (35): pp. 773-7. 1999. PMID 11263546. http://www.cdc.gov/mmwr/preview/mmwrhtml/mm4835a1.htm.
- ↑ Marrazzo JM (2004). «Barriers to infectious disease care among lesbians». Emerging Infect. Dis. 10 (11): pp. 1974-8. PMID 15550210. http://www.cdc.gov/ncidod/eid/vol10no11/04-0467.htm.
- ↑ Workowski KA, Berman SM (2006). «Sexually transmitted diseases treatment guidelines, 2006». MMWR Recomm Rep 55 (RR-11): pp. 1-94. PMID 16888612. http://www.cdc.gov/mmwr/preview/mmwrhtml/rr5511a1.htm.
- ↑ McCusker ME, Harris AD, Perencevich E, Roghmann MC (2003). «Fluoroquinolone use and Clostridium difficile-associated diarrhea». Emerging Infect. Dis. 9 (6): pp. 730-3. PMID 12781017.
- ↑ Frost F, Craun GF, Calderon RL (1998). «Increasing hospitalization and death possibly due to Clostridium difficile diarrheal disease». Emerging Infect. Dis. 4 (4): pp. 619-25. PMID 9866738. http://www.cdc.gov/ncidod/eid/vol4no4/frost.htm.
- ↑ N Chanishvili, T Chanishvili, M. Tediashvili, P.A. Barrow (2001). «Phages and their application against drug-resistant bacteria». J. Chem. Technol. Biotechnol.) 76: pp. 689-699. http://cat.inist.fr/?aModele=afficheN&cpsidt=1096871.
- ↑ D. Jikia, N. Chkhaidze, E. Imedashvili, I. Mgaloblishvili, G. Tsitlanadze (2005). «The use of a novel biodegradable preparation capable of the sustained release of bacteriophages and ciprofloxacin, in the complex treatment of multidrug-resistant Staphylococcus aureus-infected local radiation injuries caused by exposure to Sr90». Clinical & Experimental Dermatology 30: pp. 23. http://www.blackwell-synergy.com/doi/abs/10.1111/j.1365-2230.2004.01600.x?journalCode=ced.
- ↑ Weber-Dabrowska B, Mulczyk M, Gorski A. (2003). «Bacteriophages as an efficient therapy for antibiotic-resistant septicemia in man.». Transplant Proc.. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12826166.
- ↑ Mathur MD, Vidhani S, Mehndiratta PL. (2003). «Bacteriophage therapy: an alternative to conventional antibiotics.». J Assoc Physicians India 51: pp. 593-6. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Retrieve&dopt=AbstractPlus&list_uids=15266928&query_hl=13&itool=pubmed_docsum.
- ↑ Mc Grath S and van Sinderen D (editors). (2007). Bacteriophage: Genetics and Molecular Biology (1st ed. edición). Caister Academic Press. ISBN 978-1-904455-14-1 . http://www.horizonpress.com/phage.
- ↑ «Bad Bugs, No Drugs Executive Summary». Infectious Diseases Society of America. Consultado el 11-12-2007.
- ↑ Wallace RJ (2004). «Antimicrobial properties of plant secondary metabolites». Proc Nutr Soc 63 (4): pp. 621-9. PMID 15831135.
- ↑ Thuille N, Fille M, Nagl M (2003). «Bactericidal activity of herbal extracts». Int J Hyg Environ Health 206 (3): pp. 217-21. PMID 12872531.
- ↑ Singh G, Kapoor IP, Pandey SK, Singh UK, Singh RK (2002). «Studies on essential oils: part 10; antibacterial activity of volatile oils of some spices». Phytother Res 16 (7): pp. 680-2. doi:. PMID 12410554.
- ↑ Stermitz FR, Lorenz P, Tawara JN, Zenewicz LA, Lewis K (2000). «Synergy in a medicinal plant: antimicrobial action of berberine potentiated by 5'-methoxyhydnocarpin, a multidrug pump inhibitor». Proc. Natl. Acad. Sci. U.S.A. 97 (4): pp. 1433-7. doi:. PMID 10677479. http://www.pnas.org/cgi/content/full/97/4/1433.
Enlaces externos
- CDC Article on Hospital Acquired MRSA
- CDC Article on Community Acquired MRSA
- CDC Guideline "Management of Multidrug-Resistant Organisms in Healthcare Settings, 2006"
- Vancomycin Resistant EnterococcusâGuidelines for Healthcare Workers
- Alliance for the Prudent Use of Antibiotics
- Quantifying potential human health impacts of animal antibiotic use: Enrofloxacin and macrolides in chickens.
- The Rise of Antibiotic-Resistant Infections
- Information about phage therapy - a possible alternative to antibiotics in case of resistant infections
- Antibiotic-resistance genes as markers Once necessary, now undesirable
- CBS Article on Phage Therapy and Antibiotic Resistance
- BURDEN of Resistance and Disease in European Nations - An EU-Project to estimate the financial burden of antibiotic resistance in European Hospitals
Categoría:- Antibióticos
Wikimedia foundation. 2010.
