- Óxido de lantano (III)
-
Óxido de lantano (III)
Nombre (IUPAC) sistemático Trióxido de dilantano General Otros nombres Sesquióxido de lantano
LantanaFórmula semidesarrollada La2O3 Fórmula molecular n/d Identificadores Número CAS 1312-81-8 Número RTECS OE5330000 Propiedades físicas Apariencia Polvo blanco, higroscópico Densidad 6510 kg/m3; 6,51 g/cm3 Masa molar 325,81 g/mol Punto de fusión 2590 K (-270,56 °C) Punto de ebullición 4500 K (-268,65 °C) Estructura cristalina Hexagonal, hP5 Propiedades químicas Solubilidad en agua Insoluble Compuestos relacionados Otros cationes Óxido de escandio (III)
Óxido de ytrio (III)
Óxido de actinio (III)Otros compuestos Óxido de lantano y aluminio,
LaSrCoO4Peligrosidad NFPA 704 Frases R R36/37 Frases S S26, S22, S37/39 Número RTECS OE5330000 Riesgos Irritante Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl óxido de lantano (III), de fórmula química La2O3, es un compuesto químico que contiene el elemento lantano, perteneciente a las tierras raras, y el oxígeno. Se utiliza para elaborar materiales ferroeléctricos, y en materiales ópticos. La producción se realiza fundamentalmente a escala de laboratorio.
Contenido
Propiedades
La2O3 tiene la banda prohibida más grande entre los óxidos de las tierras raras con un valor de 4,3 eV, mientras que también tiene la energía reticular más baja, con una constante dieléctrica muy alta, ε = 27. Estas propiedades hacen que La2O3 sea ampliamente utilizado en la industria, así como en el laboratorio de investigación. El óxido de lantano (III) es un sólido blanco, inodoro, que es insoluble en agua, pero soluble en ácidos diluídos. Dependiendo del pH del compuesto, se puede obtener diferentes estructuras cristalinas. La2O3 es higroscópico: si se expone al aire, el óxido de lantano absorbe la humedad con el tiempo y se convierte en hidróxido de lantano. El óxido de lantano tiene propiedades semiconductoras de tipo-p, debido a que su resistencia eléctrica disminuye al aumentar la temperatura. A temperatura ambiente su resistividad media es de 10 kW·cm.
Estructura
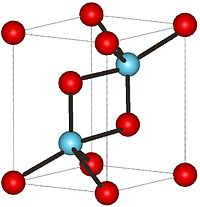
A bajas temperaturas, el compuesto La2O3 tiene una estructura cristalina hexagonal A-M2O3 . El ion metálico La3+ está rodeado por un grupo de 7 iones O2-, los iones oxígeno se encuentran distribuidos de forma octaédrica alrededor del átomo de metal y falta un ion oxígeno sobre una de las caras octaédricas[1] Por otro lado, a altas temperaturas el óxido de lantano (III), se convierte en una estructura cristalina cúbica CM2O3. El ion La3+ está rodeado por un grupo coordinado de seis iones O2- (iones óxido)[2]
Síntesis
Se han preparado diferentes formas cristalinas del óxido de lantano (III).
Para producir La2O3 hexagonal, se rocía una solución 0,1 M de LaCl3 sobre un sustrato precalentado, generalmente de calcogenuro de metal[3] El proceso puede ser visto como una etapa en dos pasos - una hidrólisis seguida por una deshidratación.:
- 2 LaCl3 + 3 H2O → La(OH)3 + 3 HCl
- 2 La(OH)3 + calor → La2O3 + 3 H2O
Una ruta alternativa para obtener La2O3 hexagonal implica la precipitación de La(OH)3 en disolución acuosa mediante una combinación de NH3 al 2,5% y el surfactante dodecilsulfato de sodio seguido de calentamiento y agitación durante 24 horas a 80 °C:
- 2 LaCl3+ 3 H2O + 3 NH3 → La(OH)3 + 3 NH4Cl
- LaCl3·3H2O → La2O3
Existen otras rutas de reacción alternativas, a partir de sulfuro de lantano (III) o de sulfato de lantano (III):
- 2 La2S3 + 3 CO2 → 2 La2O3 + 3 CS2
- 2 La2(SO4)3 + calor → 2 La2O3 + 6 SO3
Reacciones
El óxido de lantano se utiliza para elaborar materiales ferroeléctricos, como La-dopado Bi4Ti3O12 (BLT). El óxido de lantano también se utiliza en materiales ópticos, a menudo los vidrios ópticos están dopados con La2O3 para mejorar el índice de refracción del vidrio, su durabilidad química y su resistencia mecánica.
- 3 B2O3 + La2O3 → 2 La(BO2)3
Cuando esta reacción 1:3 se mezcla con un compuesto de vidrio, el alto peso molecular del lantano provoca un aumento de la mezcla homogénea de la masa fundida que lleva a un punto de fusión más bajo.[4] La adición de la La2O3 al vidrio fundido conduce a una temperatura de transición vítrea más alta, de 658 °C a 679 °C. La adición también conduce a valores más altos de densidad, microdureza, y del índice de refracción del vidrio.
Usos y aplicaciones
El La2O3 se utiliza para fabricar lentes ópticas, a las que este óxido confiere mayor densidad, índice de refracción y dureza. Junto con los óxidos de wolframio, de tántalo, y de torio, La2O3 mejora la resistencia del vidrio al ataque de álcalis. La2O3 es un ingrediente para la fabricación de materiales piezoeléctricos y termoeléctricos. Los convertidores de gases de escape de los automóviles contienen La2O3.[5] El La2O3 también se utiliza en las pantallas intensificadoras para proyección de imágenes de rayos X, fósforos o sustancias luminiscentes, así como en cerámicas dieléctricas y conductoras.
La2O3 ha sido estudiado por la reacción llamada acoplamiento oxidativo del metano.[6]
Las películas de La2O3 pueden ser depositadas por muchos métodos diferentes, incluyendo: deposición química de vapor, oxidación térmica, pulverización catódica y pirólisis de pulverización. Las deposiciones de estas películas se presentan en una gama de temperaturas de 250-450 °C. Películas policristalinas se forman a 350 °C.[3]
Referencias
- ↑ Wells, AF (1984). Estructurales Química Inorgánica. Oxford: Clarendon Press. p. 546..
- ↑ Wyckoff, GTR (1963). Crystal Structures: Inorganic Compounds RXn, RnMX2, RnMX3. Nueva York: Interscience Publishers.
- ↑ a b Kale, S.S.; Jadhav, K.R.; Patil, P.S.; Gujar, T.P.; Lokhande, C.D. (2005). «Characterizations of spray-deposited lanthanum oxide (La2O3) thin films». Materials Letters 59: pp. 3007. doi:.
- ↑ Vinogradova, N. N.; Dmitruk, L. N.; Petrova, O. B. (2004). «Glass Transition and Crystallization of Glasses Based on Rare-Earth Borates». Glass Physics and Chemistry 30: pp. 1. doi:.
- ↑ Cao, J; Ji, H; Liu, J; Zheng, M; Chang, X; Ma, X; Zhang, A; Xu, Q (2005). «Controllable syntheses of hexagonal and lamellar mesostructured lanthanum oxide». Materials Letters 59: pp. 408. doi:.
- ↑ O.V. Manoilova et al. (2004). «Surface Acidity and Basicity of La2O3, LaOCl, and LaCl3 Characterized by IR Spectroscopy, TPD, and DFT Calculations». J. Phys. Chem. B 108: p. 15770. doi:.
- Bedoya, C. "MOCVD of Lanthanum Oxides from La(tmhd)3 and La(tmod)3 Precursors: A Thermal and Kinetic Investigation." Chemical Vapor Deposition. 12 (2006): 46-53.
- Imanaka, Nobuhito. "Preparation of the cubic-type La2O3 phase by thermal decomposition of LaI3." Journal of Solid State Chemistry. 178 (2005): 395-398.
- "Lanthanum oxide." The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biological. 11th ed. 1989.
- Veldurthy, B. "Magnesium-Lanthanum Mixed Metal Oxide: A Strong Solid Base for the Michael Addition Reaction." Adv. Synth. Catal. 347 (2005): 767-771.
- "Lanthanum oxide." Encyclopedia of Chemical Reactions. 1951.
Enlaces externos
- Datos sobre el lantano (en inglés)
- Ficha de seguridad MSDS 1. (en inglés)
- Ficha de seguridad MSDS 2. (en inglés)
Categorías:- Compuestos de lantano
- Compuestos inorgánicos
- Óxidos
Wikimedia foundation. 2010.


