- Antiinflamatorio no esteroideo
-
 Comprimidos de ácido acetilsalicílico o aspirina, el prototipo de los antiinflamatorios no esteroideos, tanto por su mecanismo de acción, como por sus efectos colaterales.
Comprimidos de ácido acetilsalicílico o aspirina, el prototipo de los antiinflamatorios no esteroideos, tanto por su mecanismo de acción, como por sus efectos colaterales.
Los antiinflamatorios no esteroideos (abreviado AINE) son un grupo variado y químicamente heterogéneos de fármacos principalmente antiinflamatorios, analgésicos y antipiréticos, por lo que reducen los síntomas de la inflamación, el dolor y la fiebre respectivamente.[1] Todos ejercen sus efectos por acción de la inhibición de la enzima ciclooxigenasa.[2] Los antiinflamatorios naturales, segregados por el propio organismo, son los derivados de los corticoides, sustancias de origen esteroideo de potente acción antiinflamatoria, pero que cursan con importantes efectos secundarios.[3] En oposición a los corticoides, el término "no esteroideo" se aplica a los AINE para recalcar su estructura química no esteroidea y la menor cantidad de efectos secundarios. Como analgésicos se caracterizan por no pertenecer a la clase de los narcóticos y actuar bloqueando la síntesis de prostaglandinas.[4]
Los antiinflamatorios no esteroideos disponibles en el mercado inhiben la actividad tanto de la ciclooxigenasa-1 (COX-1) como a la ciclooxigenasa-2 (COX-2) y, por lo tanto, la síntesis de prostaglandinas y tromboxanos. Se piensa que es la inhibición de la COX-2 la que en parte conlleva a la acción antiinflamatoria, analgésica y antipirética de los AINE, sin embargo, aquellos que simultáneamente inhiben a la COX-1 tienen la capacidad de causar hemorragias digestivas y úlceras, en especial la aspirina.[1] Por lo tanto, se enfatizan las ventajas de inhibidores selectivos para la COX-2.
El AINE prototipo es la aspirina y le acompañan una gran variedad de ácidos orgánicos, incluyendo derivados del ácido propílico (como el ibuprofeno y naproxen), derivados del ácido acético (como la indometacina) y ácidos enólicos (como el piroxicam), todos competidores con el ácido araquidónico por el sitio activo de la ciclooxigenasa. El paracetamol se incluye entre los AINE, a pesar de su poca acción antiinflamatoria.[5]
Contenido
Historia
 Sauce blanco de cuya corteza se extraía una panacea que disminuía la fiebre: la salicina.
Sauce blanco de cuya corteza se extraía una panacea que disminuía la fiebre: la salicina.
Desde la época de la medicina filosófica griega hasta la mitad del siglo XIX, el descubrimiento de agentes medicinales fue catalogado como un arte empírico, donde se combinaron folklore y guías mitológicas para la utilización de productos vegetales y minerales que constituían la magra farmacopea. En el 1500 a. C. se utilizaban hojas de Arrayán; Hipócrates (460 - 377 a. C.) usó por primera vez corteza de sauce,[6] Celso en el año 30 a. C. describió los signos de la inflamación y también utilizó corteza de sauce para mitigarlos. En 1761 el reverendo Edmund Stone escribió a la Royal Society Británica sus observaciones en pacientes febriles tratados con pociones de corteza de sauce.[5] El ingrediente activo de la corteza del tronco de sauce es un glucósido amargo llamado salicina,[2] aislado por primera vez en forma pura por Leroux en 1829 y quien también describió su efecto antipirético.[5]
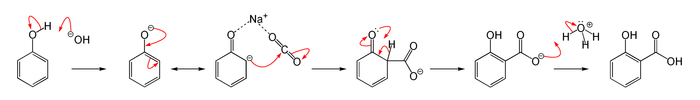
Por hidrólisis, la salicina libera glucosa y alcohol salicílico que puede ser convertido en ácido salicílico o Salicilato, tanto in vivo como por manipulación química.[6] Este ácido resultó más efectivo que la salicilina del tronco del sauce y adicional a su capacidad de reducir la fiebre, también es antiinflamatorio y analgésico. En 1869 Adolph Wilhelm Hermann Kolbe consiguió sintetizar Salicilato el cual desafortunadamente resultó demasiado corrosivo para la mucosa del estómago.[6] La reacción usada para sintetizar el ácido aromático a partir de un fenol en presencia de CO2 se conoce como Reacción de Kolbe-Schmitt:[7]
Entre 1893 y 1897 el químico alemán Felix Hoffmann, de la Compañía Bayer, inició una nueva etapa en la farmacología al convertir el ácido salicílico en ácido acetilsalicílico, al que Heinrich Dreser llamó aspirina.[5] En el siglo XX, desde la década del 50, surgió el resto de los antiInflamatorios no esteroideos (AINE).
 Uno de los primeros avisos comerciales de la Aspirina Bayer en los Estados Unidos, publicado en The New York Times en 1917.
Uno de los primeros avisos comerciales de la Aspirina Bayer en los Estados Unidos, publicado en The New York Times en 1917.
La gran cantidad de AINE en expansión desde los años 1970 creó conflictos en la decisión y elección terapéutica. Esto derivó en la necesidad de un acabado conocimiento en los mecanismos farmacodinámicos de cada uno de los antiinflamatorios como así también de su cinética y respuesta clínica.
En la década del 70 se inició una etapa fundamental en la comprensión de los AINE, donde se describieron los roles de las prostaglandinas (prostaglandinas) sobre la fiebre, dolor, contracciones uterinas, circulación sanguínea, secreción y protección gástrica. En 1971, el farmacólogo británico John Robert Vane publicó sus observaciones acerca del efecto inhibitorio que la aspirina y la indometacina ejercían sobre la enzima ciclooxigenasa (COX) y la disminución subsiguiente en la producción de las prostaglandinas, englobándose por años la explicación de los efectos terapéuticos y las reacciones adversas en el mismo concepto farmacodinámico antiprostaglandínico.[8] Por su trabajo con prostaglandinas, Vane recibió el Premio Nobel en Fisiología o Medicina en 1982.[9]
En 1990 Philip Needleman y Weilin Xie en 1991 con nuevas técnicas «ex vivo» y utilizando lipopolisacáridos bacterianos, describieron la síntesis «de novo» de una proteína COX. Se identificó la COX inducida como una isoforma distinta a la descrita por Vane y codificada por un gen diferente al que llamó COX-2.[10] Este descubrimiento modificó en los últimos años los conocimientos, explicándose que las acciones antiinflamatorias surgieran de la inhibición COX-2 (inducible), mientras que los efectos adversos están relacionados con la inhibición de la COX-1.
El consumo de AINE en el mundo se estima en torno a 216 millones de dosis al día, con una media de consumo de 100 comprimidos de aspirina por persona y año en EE.UU.[11]
Clasificación química
Con el advenimiento de los inhibidores de la ciclooxigenasa (Coxib) o inhibidores selectivos de la COX-2, la tendencia actual en las clasificaciones es a agruparlos según su capacidad —en una determinada concentración y utilizando métodos in vitro— de inhibir el 50% de la COX-2 en comparación con la concentración necesaria para inhibir el 50% de la COX-1. Las variaciones que se han visto en los datos reportados en los últimos años se relacionan con los diversos métodos experimentales de investigación utilizados para hallar resultados que ubiquen a un AINE en valores que indiquen su selectividad COX.[12] De ahí que resumiendo todos los datos obtenidos se ha intentado agrupar a los AINE según:
- Equipotencia inhibidora de COX-2 versus COX-1
- El porcentaje de inhibición de COX-1 cuando se inhibe el 80% de la COX-2, que correspondería
- La concentración necesaria de un AINE para lograr efectos terapéuticos relevantes
Los AINE, entonces, se pueden agrupar de acuerdo con su mecanismo de acción en inhibidores no selectivos de la ciclooxigenasa e inhibidores selectivos de la ciclooxigenasa-2.[13]
De otras clasificaciones posibles para los AINE, quizás la más utilizada sea la que se basa en su estructura molecular. En función a la estructura química básica sobre la que se desarrolla cada fármaco, estos pueden ser:
Clasificación de los AINE[5] Salicilatos Derivados indol-acéticos Derivados arilo-acéticos Ácidos enólicos Ácido acetilsalicílico
Clonixinato de lisina
Benorilato
Diflunisal
Salicilamida
Etersalato
Salsalato o ácido salicílicoAcemetacina
Glucametacina
Indometacina
Proglumetacina
Oxametacina
Sulindac
Tolmetin
DifenpiramidaAceclofenaco
Diclofenaco
Etodolaco
Fentiazaco
Ketorolaco
Bufexamaco
Lonazolaco
Alclofenaco
ZomepiracoOxicanes: Pirazolonas: Fenilbutazona
Mofebutazona
Oxifenbutazona
Clofezona
Kebuzona
Metamizol (Dipirona)
Feprazona
Nifenazona
Suxibuzona
Aminofenazona
Aspirina
Derivados Arilpropiónicos Fenematos Otros Butibufeno
Fenoprofeno
Fenbufeno
Flurbiprofeno
Benoxaprofeno
Suprofeno
Ibuprofeno
IbuproxamKetoprofeno
Dexketoprofeno
Pirprofeno
Indoprofeno
Naproxeno
Oxaprozina
Tiaprofeno
Dexibuprofeno
Fenoprofeno
Flunoxaprofeno
AlminoprofenoÁcido meclofenámico
Ácido mefenámico
Ácido flufenámico
Ácido tolfenámico
Ácido niflúmico
Etofenamato (tópico)Varios - Nabumetona
- Glucosamina
- Diacereína
- Nimesulida
- Proquazona
- Azapropazona
- Benzidamina (tópico)
- Orgoteína
- Feprazona
- Morniflumato
- Tenidap
- Glucosaminoglicano, polisulfato
Coxibes:
Para-aminofenol:(Acetaminofen)
Valdecoxib
Hasta el año 1998 se consideraba racional clasificar a los AINE según su estructura química. Aunque el paracetamol no tiene propiedades antiinflamatorias, clásicamente se ha agrupado como un AINE. En la actualidad se considera que esto sólo tiene importancia en situaciones relacionadas a fenómenos de idiosincrasia y de hipersensibilidad a un compuesto o grupo químico particular.Farmacocinética
Se ha demostrado una relación entre la concentración del medicamento en el plasma sanguíneo y la respuesta antiinflamatoria en pacientes que toman antiinflamatorios no esteroideos —como aquellos con artritis reumatoide o con dolor postoperatorio. En la administración de los AINE, se han observado diferencias farmacocinéticas entre un paciente y otro a la misma dosis.[14] [12] Existe también una relación directa entre la dosis administrada y el riesgo de perforación o sangrado en el tracto gastrointestinal superior.[15]
Con la excepción de los Coxib,[16] y los para-aminofenoles como el acetaminofen,[12] los antiinflamatorios no esteroideos son ácidos orgánicos débiles con un pKa menor a 5 y permanecen disociados a un pH 2 unidades por encima de su pKa. Algunos como el diclofenaco, el ibuprofeno, el naproxen y la indometacina son ácidos carboxílicos, mientras que otros como la fenilbutazona son ácidos enólicos.[16] La nabumetona es una cetona administrada como un profármaco que luego es metabolizado a su forma activa ácida.[17]
La vía de elección para la administración de algunos AINE en el tratamiento del dolor agudo, es la intravenosa dado que permite un rápido comienzo de acción siendo conveniente una dosis de carga que dependerá del fármaco para llegar a la ventana terapéutica rápidamente con efectos secundarios minimos.[18] Por vía oral, poseen una rápida y buena absorción, incluyendo en pacientes veterinarios.[19]
Presentan una elevada unión a proteínas plasmáticas y una buena distribución por difusión pasiva pH dependiente, así como gran liposolubilidad.[19]
La vida media de los AINE es muy variable por lo que se los divide en tres grupos:[20]
- Vida media corta (<6 h): aspirina, diclofenaco, etodolaco, fenoprofeno, ibuprofeno, indometacina, ketoprofeno
- Vida media intermedia (entre 6 y 10 h): diflunisal, fenbufen, carprofeno
- Vida media larga (>10 h): nabumetona, naproxeno, fenilbutazona, piroxicam y sulindac
Aunque existen presentaciones de liberación sostenida para los AINE con una vida media muy corta con el fin de prolongar su efecto, no se ha demostrado que dichas fórmulas conlleven alguna ventaja terapéutica, excepto que la administración del medicamento es menos frecuente.
Los AINE se metabolizan por vía hepática, presentando efecto de primer paso. Por lo general, son altamente metabolizados, bien siguiendo la fase I y luego la fase II o bien directamente a la glucuronidación. La mayoría son metabolizados por la familia enzimática del citocromo P450 CYP3A como el CYP3A4 o CYP2C como el CYP2C19 o CYP2C9, del citocromo P450 hepático.[17] Tienen buena biodisponibilidad (las excepciones notables son el diclofenaco: 54% y la aspirina: 70%), la unión proteica es reversible y extensa por lo que los volúmenes de distribución son muy pequeños, su excreción es fundamentalmente renal y, en su mayoría, en forma de metabolitos. La velocidad de absorción de AINE tiende a verse reducida con los alimentos, aunque en la mayoría de los casos se recomienda su administración con alimentos o antiácidos para minimizar el efecto negativo sobre la mucosa gástrica, sobre todo en tratamientos prolongados.[20] A pesar de que tarda más en absorberse el medicamento con comida, el total absorbido no disminuye. Debido a que la unión proteica es saturable, a medida que la dosis aumenta, la concentración plasmática del naproxeno, salicilato, fenilbutazona y posiblemente el ibuprofeno aumentan de manera no proporcional a como iban en aumento a dosis bajas.
Características farmacológicas de los AINE† Grupo Salicilatos Paraaminofenoles Derivados pirazólicos Derivados del ác. propiónico Oxicanes Derivados del ác. acético Inhibidores de la COX-2 Fenamatos Vía Oral Parenteral Parenteral Digestiva Digestiva Parenteral Oral Digestiva Alimentos y absorción Disminuyen Disminuyen No influyen No influyen No influyen -- -- -- Biodisponibilidad 100% 75%-90% -- -- -- -- -- -- Unión a proteínas plasmáticas 99% Variable 98% 99% 99% 90% -- -- Atraviesa barrera hematoencefálica SI -- -- -- -- -- -- -- Metabolismo Hepático saturable - Hidrólisis.
Hepático - Glucuronidazión
- Sulfurización
Hepático - Hidroxilación
- Desmetilación
- Glucuronidazión
Hepático - Hidroxilación
- Glucuronidazión
Hepático - O-desmetilazión
- N-desacetilación
- Glucuronidazión
- Reductasas citosólicas
- CYP2C9
- 3-hidroximetilación
- 3-carboxilación
Excreción Orina 90% orina inalterado -- -- - -- -- -- Semivida 20 m. 2-2.5 h. 1-1.5 h. 2-4 h. -- 1-6 h. 17 h. 2-4 h. †Los parámetros que caracterizan la farmacocinética de una sustancia son muy variables, aún entre los miembros de una misma familia. Por ello, a la hora de realizar esta tabla de síntesis se ha incluido fundamentalmente el fármaco más representativo de cada grupo.  Ácido acetilsalicílico (gris y rojo) unido a una molécula de ciclooxigenasa 2 inactivando los sitios activos de la enzima.
Ácido acetilsalicílico (gris y rojo) unido a una molécula de ciclooxigenasa 2 inactivando los sitios activos de la enzima.
Salicilatos
La aspirina y otros salicilatos se absorben bien y rápidamente en estómago y duodeno, con la interacción de la presencia de alimentos en el estómago o el pH. La absorción por el recto suele ser más lenta que la vía oral, y es incompleta y no fiable. La aspirina suele venir en presentaciones recubiertas de una capa entérica o en fórmulas de liberación lenta para reducir la irritación gástrica clásica de las presentaciones solubles.[21]
La biodisponibilidad es muy elevada y se unen a las proteínas plasmáticas en un 80-90% (sobre todo a la albúmina), con lo que se distribuyen en todos los tejidos corporales y líquidos transcelulares. Son transportados activamente al líquido cefalorraquídeo y cruzan fácilmente la barrera placentaria.[22]
Los salicilatos se metabolizan en el retículo endoplásmico y las mitocondrias del hígado, produciendo ácido salicilúrico, glucurónido de éter (fenólico) y glucurónido de éster (acilo).[21]
Dosis antiinflamatoria recomendada Fármaco Dosis 1° Aspirina 1200-1500 mg tid El tratamiento prolongado produce cierto grado de inducción hepática, que tiende a reducir los niveles plasmáticos del fármaco. Se excretan por la orina como ácido salicílico libre (10%), ácido salicilúrico (75%), glucurónido de éter/éster (10%/5%) o ácido gentísico (menos del 1%).[23] En la orina alcalina puede eliminarse como ácido salicílico libre más de 30% del fármaco ingerido.[24]
La vida media de eliminación de la aspirina es de 15-20 minutos, la del salicilato es de 2-3 horas (en dosis bajas) y de 12 horas a las dosis antiinflamatorias usuales.[25]
Paraaminofenoles
Dosis antipirética recomendada Fármaco Dosis 1° Paracetamol 325–500 mg c/6h Dosis analgésica recomendada Fármaco Dosis 1° Paracetamol 2 a 4 gr/día 2° Metamizol <3 g/día El acetaminofen se absorbe de manera rápida y casi completa a través del tubo digestivo, teniendo una biodisponibilidad cercana al 100% (entre 75-90% en el caso de otros para-aminofenoles). La velocidad de absorción depende fundamentalmente de la velocidad de vaciamiento gástrico. Se alcanza una concentración máxima plasmática en 30-90 minutos. Se absorbe bien por vía rectal, aunque más lentamente que en el tubo digestivo alto. Su fijación a proteínas plasmáticas es variable, pero a concentraciones tóxicas se fijan un 20-50%. El 95% del fármaco se metaboliza en el hígado conjugado con ácido glucurónico (60%) o sulfúrico (35%). Su vida media es de 2-2.5 horas, aunque es mayor en recién nacidos y en pacientes con insuficiencia hepática. Después de una dosis terapéutica es posible identificar en orina 90-100% del fármaco en las primeras 24 horas, principalmente conjugado con cisteína y ácido mercaptúrico y una minoría excretada en forma libre.[12]
Derivados pirazólicos
Dosis antiinflamatoria recomendada Fármaco Dosis 1° Fenilbutazona 300 mg/día[26] 2° Oxifenbutazona 300-600 mg/día[27] El metamizol (dipirona) se absorbe bien por vía oral, alcanzando una concentración máxima en 1-1.5 horas. Se hidroliza a 4-metilaminoantipirina y 4-aminoantipirina (ambos activos), y 4-formilaminoantipirina (que es inactivo). La vida media de los metabolitos activos es de 2.5-4 horas, valores que aumentan con la edad del paciente.
La propifenazona se absorbe bien por vía oral y alcanza una concentración máxima en 0.5-1 hora y tiene una semivida de 1-1.5 horas.
La fenilbutazona se absorbe rápido y por completo a través del tracto gastrointestinal. El 98% del fármaco se une a proteínas plasmáticas. Tiene una vida media de 50-65 horas. Uno de sus metabolitos, la oxifenbutazona, posee también actividad antirreumática, se une ampliamente a las proteínas plasmáticas y tiene una vida media de varios días.
Derivados del ácido propiónico
 Ibuprofeno (figura de bolitas), un derivado del ácido propiónico, unido a una molécula de ciclooxigenasa 1.
Ibuprofeno (figura de bolitas), un derivado del ácido propiónico, unido a una molécula de ciclooxigenasa 1.
Todos se absorben de forma bastante completa por vía oral. Los alimentos reducen la velocidad de absorción, pero no la cantidad absorbida. La absorción por vía rectal es lenta e irregular. Se unen intensamente a la albúmina (alrededor del 99%) a las concentraciones plasmáticas habituales. En la cirrosis hepática, artritis reumatoide y en ancianos aumenta la fracción libre del fármaco.
Difunden bien y pasan al líquido sinovial, donde alcanzan concentraciones del 50-70% con respecto a las del plasma sanguíneo. En administración crónica, estas concentraciones son más estables que las plasmáticas. Atraviesan la placenta y alcanzan concentraciones muy bajas en la leche materna (naproxeno: 1%). Su metabolismo es intenso y variado, de forma que la excreción renal activa es mínima (<1%). Entre los procesos metabolizadores destacan la hidroxilación, la desmetilación y la conjugación (principalmente con ácido glucurónico). Las semividas de eliminación oscilan entre 2 y 4 horas, excepto para el flurbiprofeno (5.5 horas) y el naproxeno (13-14 horas). El piquetoprofeno se emplea sólo por vía tópica. Existen presentaciones formuladas para retardar la liberación del ketoprofeno para que se administre una vez al día en vez de dos o tres.
Oxicams
Dosis antiinflamatoria recomendada[17] Fármaco Dosis 1° Meloxicam 7,5-15 mg c/día 2° Piroxicam 10-20 mg/día 3° Tenoxicam 20-40 mg/dosis única/día Tras administrar por vía oral los oxicams, como el piroxicam, el más ampliamente usado, y el tenoxicam se absorben completamente, alcanzando una concentración máxima plasmática en 2-4 horas.[28] Los antiácidos y alimentos no modifican la rapidez ni la magnitud de su absorción. Sufre una importante recirculación enterohepática, lo que le da una semivida prolongada (50 horas aproximadamente, aunque varía mucho de persona a persona).
Se unen de manera extensa a las proteínas plasmáticas (99%) por lo que tienen un volumen de distribución muy pequeño y una depuración plasmática igual de baja. El piroxicam se distribuye al líquido sinovial, donde alcanza el 50% de la concentración plasmática, aproximadamente (aunque después de 7-12 días, las concentraciones son aproximadamente iguales en el plasma sanguíneo y líquido sinovial). La principal transformación metabólica es la hidroxilación, mediada por citocromo P450, y la glucuronidación, de forma que sólo el 5-10% se excreta por orina y heces sin metabolizar.[28]
Con el fin de reducir la irritación gastrointestinal causada por el piroxicam, se han sintetizado prodrogas como el ampiroxicam, droxicam y el pivoxicam.[28]
Derivados del ácido acético
La indometacina se absorbe de manera rápida (tmáx = 2 horas) y casi completa (90% en 4 horas) por vía oral. Por vía rectal la absorción es igualmente rápida, pero la concentración máxima alcanzada es inferior, por lo que algunas de sus reacciones adversas (cefaleas o aturdimiento) pueden desaparecer al emplear esta vía. Se distribuye por todo el organismo y en el líquido sinovial alcanza concentraciones similares a las del plasma sanguíneo en 5 horas. Se une a las proteínas plasmáticas en un 90%. La indometacina está sujeta a un considerable reciclaje biliar, lo que prolonga su vida media efectiva.[20]Se metaboliza por O-desmetilación (50%), N-desacilación y conjugación con ácido glucurónico (10%). El 10-20% se elimina sin metabolizar por secreción tubular activa, secreción que puede ser inhibida por probenecid. Su vida media es variable (1-6 horas), tal vez debido a las diferencias en la circulación enterohepática de las personas.
Inhibidores de la COX-2
Dosis antiinflamatoria recomendada[17] Fármaco Dosis 1° Celecoxib 100-200 mg/12h 2° Rofecoxib Retirada autorización UE 3° Valdecoxib Retirada autorización UE Después de ingeridos los inhibidores selectivos de la COX-2, como el celecoxib o el rofecoxib se absorben con facilidad y se liga casi en su totalidad a proteínas plasmáticas (97,4%) y una amplia distribución tisular.[29] Su metabolismo se lleva a cabo por las reductasas citosólicas del hígado, fundamentalmente P450 2C9, que producen tres metabolitos inactivos: un alcohol primario, el ácido carboxílico correspondiente y el conjugado glucurónido. Gran parte del fármaco es excretado por orina en forma de metabolitos, y el 14% es excretado por heces, sin cambios. Su vida media es de unas 11-17 horas.
Se han notificado casos de interacciones con medicamentos metabolizados por la misma enzima del citocromo P450, incluyendo rifampicina, metotrexato y warfarina.[30]
Derivados del ácido antranílico
Dosis antiinflamatoria recomendada[17] Fármaco Dosis 1° Meclofenamato 100 mg c/6h 2° Ác. mefenámico 250 mg c/6h Se alcanzan concentraciones máximas plasmáticas en 0.5-2 horas después de ingerir una dosis de meclofenamato, y en 2-4 horas después de ingerir ácido mefenámico. Ambos poseen vidas medias similares (2-4 horas). El ácido mefenámico es metabolizado en el hígado por el complejo CYP2C9.[31]
La mitad de la dosis de ácido mefenámico se excreta por orina, principalmente en forma de metabolito 3-hidroximetilo conjugado o como metabolito 3-carboxilo y sus conjugados. El 20% del producto es expulsado por las heces, sobre todo como metabolito 3-carboxilo no conjugado.[31]
Otros
La nimesulida se absorbe de forma rápida y casi completa por vía oral, por vía rectal su biodisponibilidad es de 70%. Se fija a las proteínas plasmáticas en un 99%. Sufre intensa metabolización, principalmente a 4-hidroxi-nimesulida, eliminándose por orina en un 70% y heces en un 20%. Su vida media está entre 1.5-5 horas.
Quiralidad
La mayoría de los AINE, especialmente los derivados del ácido propiónico, son moléculas que tienen un centro de asimetría, por lo que pueden existir en dos isómeros ópticos o enantiómeros—el diclofenaco es una notable excepción—.[33] Para algunos de estos casos, existen enzimas isomerasas en el organismo que convierten al enantiómero inactivo a su forma opuesta activa. Por ejemplo, el ibuprofeno y el ketoprofeno existen en preparaciones compuestas sólo por el enantiómero activo: el dexibuprofeno y dexketoprofeno respectivamente, que son los enantiómeros de configuración (-S). Por su parte, el naproxeno siempre ha sido preparado en su froma enantiómera inactiva. Ambos enantiómeros del sulindaco son activos y tienen efectos antiinflamatorios equiparables. El resto de los AINE con quiralidad vienen en presentaciones mixtas de enantiómeros, es decir, la misma cantidad del enantiómero -R que del -S.[20]
Farmacodinámica
En los últimos años ha habido un considerable progreso en dilucidar el mecanismo por el cual los antiinflamatorios no esteroideos causan sus efectos. A pesar de la gran diferencia química de estos medicamentos, todos comparten acciones terapéuticas y efectos secundarios muy similares.
Mecanismos de acción
La acción principal de todos los AINE es la inhibición de la ciclooxigenasa, una enzima que convierte el ácido araquidónico en endoperóxidos cíclicos, los cuales se transforman en prostaglandinas y en tromboxanos mediadores de la inflamación y factores biológicos locales, no circulantes llamados autacoides, incluyendo los eicosanoides.[5] La inhibición de la síntesis de prostaglandinas y tromboxanos por los AINE sería responsable de su actividad terapéutica y de los varios efectos tóxicos de este grupo de fármacos. Esta inhibición puede ocurrir por distintos mecanismos:[2]
- Inhibición irreversible, como en el caso de la aspirina
- Inhibición competitiva, como en el caso del ibuprofeno
- Inhibición reversible no competitiva, como el paracetamol
Al inhibir a la ciclooxigenasa y la subsecuente síntesis de prostaglandinas, se reduce la liberación de sustancias y mediadores inflamatorios, previniéndose la activación de los nociceptores terminales. De modo que los AINE alivian el dolor asociado con la inflamación.[14] Los AINE actuales no pueden inhibir la vía de la lipooxigenasa por lo que continúan formándose leucotrienos y otros mediadores activos, lo que explica la limitación de éstos fármacos para controlar los procesos en los que intervengan numerosos mediadores.
La ciclooxigenasa tiene dos isoformas, la ciclooxigenasa-1 (COX-1)—presente en la mayoría de los tejidos que sintetizan prostaglandinas como el riñón, la mucosa del estómago, duodeno y plaquetas—y la ciclooxigenasa-2 (COX-2)—presente en los tejidos donde se monta una respuesta inflamatoria como el cerebro, pulmón, páncreas, placenta y ovarios—.[13] La inhibición sobre la actividad enzimática de las isoformas de las ciclooxigenasas depende del fármaco en cuestión. Existen estudios que parecen demostrar que la actividad analgésica de los AINE se realiza también a través de la COX-1.[34] No obstante, también se han propuesto nuevos mecanismos independientes de la COX por los que los AINE actúan como analgésicos. Se propone que el gen c-Fos, que se expresa durante el proceso nociceptivo es reprimido por el ketoprofeno,[35] la indometacina[36] y nuevos AINE como el lornoxicam,[37] con lo que disminuye el dolor y la inflamación. Por último, el hecho de que los AINE no produzcan sueño, ni alteren el humor, ni provoquen alteraciones en la conciencia hace postular que su sitio de acción sea el hipotálamo.
Otros mecanismos de acción sugeridos para los AINE son:
- Interferencia con la activación de neutrófilos: Los AINE inhiben la capacidad de adherencia de las células sanguíneas blancas, especialmente neutrófilos; con la consecuente inhibición de la quimiotaxis y de la agregación de neutrófilos[38]
- Estimulación de la vía óxido nítrico-GMPc: Se ha demostrado que a nivel del nociceptor existe un equilibrio entre el simpático (AMPc) y el parasimpático (GMPc)[39] [40] Cuando un estímulo nocivo provoca la liberación de bradicinina, ésta estimula la liberación de prostaglandinaE2 y aminas simpáticas, las cuales provocan aumento del AMPc, rompiendo el equilibrio y apareciendo el dolor. Los AINE estimulan la liberación de óxido nítrico y determinan un incremento de GMPc, con lo cual se restablece el equilibrio AMPc/GMPc a nivel del nociceptor
- Bloqueo de las citocinas: los AINE inhiben indirectamente la liberación de citocinas a través de su acción sobre el factor de necrosis tumoral alfa[41]
- Disminución en la expresión de canales iónicos sensibles a ácido (ASICs): Estudios recientes demuestran la existencia de canales sensibles al pH que emiten señales de dolor a pH ácido. La administración de AINE reduce el dolor inducido por bajo pH al evitar la acidosis que acompaña a un proceso inflamatorio, además de inhibir directamente a los ASICs. Esta acción analgésica se ejerce en el SNC por medio de dos mecanismos:
- La inhibición de formación de prostaglandina disminuye el procesamiento de los mensajes del dolor[14]
- A nivel medular interfiere con los receptores de la sustancia P y a nivel supramedular activaría vías supraespinales inhibitorias de nocicepción[14]
El objetivo de la nueva generación de AINE es la búsqueda de inhibidores selectivos de la COX-2 para evitar los efectos adversos de la inhibición de COX-1. La mayoría de los AINE disponibles en el mercado inhiben de manera no selectiva a las ciclooxigenasas, incluso en mayor medida a la COX-1; con excepciones de nabumetona, nimesulida y meloxicam con selectividad por COX-2, aunque no absoluta. Los primeros AINE considerados inhibidores selectivos de la COX-2 fueron celecoxib y rofecoxib, pero la ventaja de su uso se ve disminuida por la inhibición de la enzima en tejidos donde es constitutiva, interfiriendo así en el funcionamiento renal, la ovulación y las acciones vasculares; pero el beneficio de suprimir las lesiones gastrointestinales representa un incentivo importante para su difusión.
Efectos
La acción de los antiinflamatorios no esteroideos son fundamentalmente tres: aliviar el dolor por sus acciones analgésicas, reducir la inflamación por sus acciones antiinflamatorias y reducir la fiebre por sus acciones antipiréticas.
Acción analgésica
La acción analgésica es, en gran medida, un efecto periférico y está relacionada con la inhibición de la síntesis de prostaglandinas en el lugar en el que se percibe el dolor.[2] Es posible que haya una intervención adicional por parte de los AINE a nivel de mecanismos centrales.[14] Todos los AINE inhiben la actividad de la ciclooxigenasa y este efecto subraya su actividad analgésica.[1] Previenen la sensibilización de los nociceptores y mantienen el umbral fisiológico de respuesta de estímulos nociceptivos. A nivel central podrían considerarse inductores de la liberación de neurotransmisores inhibidores de la respuesta dolorosa.
Son eficaces en cuadros donde la hiperalgesia está mediada por prostaglandinas, por lo que serán útiles en dolores con componente inflamatorio crónico o agudo, como lo son el dolor cólico nefrítico o biliar, politraumatizados, quemados y postoperatorio.[42]
Son más antiálgicos que analgésicos en razón que no bloquean las prostaglandinas ya liberadas.[14] Tienen dosis techo, por encima de la cual no aumenta el efecto analgésico, pero sí los efectos secundarios; por tanto, ya que no existen efectos aditivos entre los AINE, no se deben asociar. Hay una gran variabilidad en la respuesta individual.
Los AINE son fármacos completamente necesarios para controlar el dolor agudo y crónico, pudiendo ser administrados tanto antes como después de una lesión, ya que actúan por mecanismos que no sólo dependen de la inhibición de las COX.
Acción antipirética
Véase también: TermorregulaciónLa acción antifebril de los AINE es consecuencia de su capacidad inhibidora de la síntesis de prostaglandina por la ciclooxigenasa a nivel central, fundamentalmente la preóptica hipotalámica que regula la temperatura corporal.[12] La prostaglandinaE2, cuya liberación es estimulada por la acción de diferentes pirógenos, actúa como mediador de la respuesta febril al alterar el punto fijo de la temperatura. Los AINE reducen la temperatura corporal si ésta se halla previamente aumentada por el pirógeno. Sin embargo, no afectan la temperatura corporal en condiciones normales ni en caso de golpe de calor.[2] Los salicilatos y el ibuprofeno—mas no el acetaminofen—son capaces de inhibir la prostaglandinaE2 mediante la reducción de la translocación nuclear del NF-κB con la consecuente reducción en la expresión de la COX-2.[12]
Acción antiinflamatoria
Inflamación aguda
Debido no solamente a la inhibición de la síntesis de prostaglandina, sino también porque son capaces de desestructurar la secuencia de hechos a través de los cuales las células inflamatorias responden a señales extracelulares, mediante la interferencia con el papel de los neutrófilos en la inflamación.
Inflamación crónica
Los AINE no sólo actúan como antiinflamatorios por su inhibición de síntesis de prostaglandina o de las fases iniciales de la acción de PMN, sino que también de manera directa o indirecta modifican otros mediadores de la inflamación:
- Radicales de oxígeno y metabolitos citotóxicos[13]
- Producción del factor de necrosis tumoral alfa (TNF) e interleucinas, incluyendo IL-1 e IL-4 leucocitarias.[13]
- Las citocinas que intervienen en la inflamación crónica
- El sistema del complemento que desarrolla actividades proinflamatorias, como la capacidad quimiotáctica del factor C5a.[12]
- Las quininas (bradicinina y precalicreína) que sensibilizan terminales nerviosas produciendo dolor
- Las aminas vasoactivas (histamina y serotonina) que favorecen el incremento de permeabilidad vascular, producidas en plaquetas, mastocitos y basófilos
Esta capacidad de los AINE a nivel periférico para bloquear o inhibir todos o algunos factores mediadores de la inflamación enfatizan su importancia en la evolución de la respuesta inflamatoria crónica y el dolor asociado a estas inflamaciones, entre ellos en la artritis reumatoide.[12]
Otros efectos de los AINE
Metabolismo
El metabolismo humano se ve modificado en distintos puntos por la acción de todos o algunos de los AINE.
- Metabolismo glucídico: aumentan el consumo de glucosa y la producción de lactato; además inhiben las deshidrogenasas y la 6-fosfofructoquinasa de la glicólisis y la vía de las pentosas, reducen la producción de ATP mitocondrial y AMPc. Interfieren además en la actividad de diversas reacciones anabólicas relacionadas con la síntesis de glicosaminoglicanos, glicoproteínas y colágeno del tejido conjuntivo.[11]
- Equilibrio ácido-base: los salicilatos estimulan directamente el centro respiratorio a concentraciones elevadas, favoreciendo la alcalosis respiratoria.
Enfermedad de Alzheimer
Algunos estudios parecen justificar la utilización de los AINE en el Alzheimer.[a] Una de las teorías de la patogenia de la enfermedad de Alzheimer propone que una serie de eventos conllevan a la acumulación extracelular de amiloide, principalmente la proteína estructural de la membrana plasmática neuronal llamada APP (amyloid precursor protein), la cual empieza a ser degradada por una vía metabólica alternativa produciendo fragmentos de beta-amiloide, insolubles y neurotóxicos, primero alterando el funcionamiento y finalmente produciendo la muerte celular. Esto parece estar mediado por mecanismos de estrés oxidativo y mediadores proinflamatorios.[43] [44] En los estudios de dichos mecanismos inflamatorios, también se ha informado que las prostaglandinas (prostaglandina) liberadas durante la reacción inflamatoria, causan rápidos cambios degenerativos, fundamentalmente la prostaglandinaA1. Se ha sugerido que las prostaglandinas inducen elevación del péptido beta-amiloide que conduce a la acumulación de proteínas anormales, las cuales contribuyen a la degeneración y muerte neuronal. Además, la COX-2 se expresa en altas concentraciones en las células degenerativas del cerebro, y se ha sugerido que los AINE selectivos de la COX-2 pueden disminuir su excesiva expresión a este nivel, dando como resultado un tratamiento profiláctico más apropiado, en especial en los años que preceden la aparición del cuadro clínico de la enfermedad.[45] Igualmente, los AINE también pueden reducir la excesiva activación de factores transcripcionales, responsables de la iniciación de la transcripción de genes proinflamatorios. Por otro lado, se ha sugerido que son capaces de proteger las neuronas de forma directa al reducir las respuestas celulares al glutamato.
Cáncer
Otro mecanismo de acción en el cual pueden usarse los AINE es como quimiopreventivos, ya que diversos estudios han mostrado que la COX-2 y la prostaglandina-E se expresan en la angiogénesis tumoral y de células neoplásicas y en la neovascularización dependiente de VEGF.[41] La expresión de COX-2 se encuentra elevada hasta en el 90% de los casos de cáncer de colon esporádico y hasta en el 40% de los adenomas colónicos y sin elevación en el epitelio del colon normal.
La aspirina y otros AINE administrados en forma regular parecen estar asociados a una disminución en el riesgo del cáncer de colon.[46] La aspirina previene el riesgo de cáncer de colon metastásico y la aparición de adenomas intestinales en pacientes con cáncer colorrectal previo.[47] La aspirina a bajas dosis, unas 16 o más dosis de 325 mg cada mes por al menos 1 año pueden reducir el riesgo de cáncer de colon letal en un 40-50%.[48] El mecanismo preciso por el cual se logra esta disminución se desconoce, aunque puede estar relacionado con la inhibición de la ciclooxigenasa, pues en la mayoría de los tumores epiteliales, incluyendo el cáncer de colon, expresan altos niveles de COX-2. Se ha postulado que podría ser a través de la inducción de apoptosis, disminución de angiogénesis o ambas.
Un estudio reciente demostró el efecto protector del celecoxib en pacientes con poliposis familiar adenomatosa,[49] cuyo riesgo de cáncer de colon es de casi el 100%.[b] Se ha demostrado que el sulindac induce la apoptosis e inhibe el crecimiento tumoral in vivo en pacientes con carcinoma de células escamosas de cabeza y cuello[50] y reduce el número de pólipos en el colon y recto.[51]
Trombogénesis
La aspirina inhibe a la COX-1 en las plaquetas previniendo la formación de infartos.[53] [54] Por su parte, los inhibidores selectivos de la COX-2 no inhiben al tromboxano A2, y dicha consecuencia podría más bien incrementar el riesgo de trombosis. El tromboxano A2 no solamente estimula la agregación plaquetaria sino también es un vasoconstrictor potente. Sus efectos pueden ser antagonizados por la prostaciclina, una prostaglandina vasodilatadora y la inhibición de la agregación plaquetaria. La prostaciclina es producida en gran parte por la COX-2, en tejidos vasculares y probablemente por eso los vasos se ven afectados con el uso de inhibidores selectivos. La inhibición de la COX-2 sin la inhibición de la COX-1 puede mantener la síntesis del tromboxano A2 con su efecto vasoconstrictivo e inhibir la producción de la prostaciclina como vasodilatador y de esa manera inclinar el efecto hacia la vasoconstricción y la trombosis. Lo cierto es que la síntesis de prostaciclina es reducido por los inhibidores selectivos de la COX-2 dando como resultado una mayor producción de tromboxano A2 que es un protrombótico.
Interacciones
Todos los antiinflamatorios no esteroideos presentan interacciones cuando se combinan con ciertos medicamentos al mismo tiempo. Estas interacciones hacen que la concentración en el plasma sanguíneo de los AINE sea mayor de la deseada con la dosis administrada, o bien puede hacer que la concentración plasmática del otro medicamento aumente o disminuye anormalmente. El alcohol consumido con el licor puede potenciar los efectos secundarios sobre el hígado o el estómago cuando se combina con el paracetamol o con la aspirina respectivamente.[13]
Fármacos que interaccionan con los AINE† Fármaco AINE implicados Resultado de la interacción Metrotexato Todos Disminuye la excreción Digoxina Todos Aumento de la concentración plasmática Aminoglicósidos Todos Aumento de la concentración plasmática Probenecid Todos Disminuye el metabolismo y el aclaramiento de los AINE Quinolonas Todos Aumenta el riesgo de convulsiones Ciclosporina, Tacrolimus Todos Aumenta el riesgo de nefrotoxicidad
Antihipertensivos Todos Antagonismo del efecto antihipertensivo Diuréticos Todos - Aumenta el riesgo de nefrotoxicidad - Disminuye el efecto diurético
IECA Todos Riesgo de insuficiencia renal y de hipercalemia Clopidogrel Todos El riesgo de hemorragia aumenta Pentoxifilina Todos Aumento del riesgo de hemorragia Litio Todos menos el AAS Disminuye la excreción de litio Anticoagulantes Fenilbutazona Aumenta el efecto anticoagulante Antidiabéticos orales Fenilbutazona Disminuye el metabolismo de las sulfonilureas Fenitoína Fenilbutazona Aumento de la concentración plasmática Colestiramina Meloxicam La excreción del meloxicam aumenta †Esta tabla resume la actuación de los AINE frente a los fármacos o grupos farmacológicos más usados. Como en otros apartados, las interacciones de los AINE son muy variables, incluso dentro de cada grupo, dependiendo mucho de cada fármaco en concreto. Uso clínico
El alivio de los síntomas asociados a la inflamación se logra tratando el dolor, el cual tiende a ser la principal y más notable molestia del paciente, y reduciendo en lo posible la cantidad de tejido dañado durante el proceso inflamatorio. El reducir la inflamación con antiinflamatorios no esteroideos a menudo trae mejoría clínica por períodos de tiempo importantes. Los analgésicos no opioides como la aspirina también suelen tener efectos antiinflamatorios, de modo que son adecuados para el tratamiento de trastornos inflamatorios agudos y crónicos.
Los glucocorticoides también tienen efectos antiinflamatorios y, cuando se presentaron al mercado por primera vez, fueron considerados como el medicamento utópico para el tratamiento de la artritis inflamatoria. Lamentablemente, su uso se ve limitado a la toxicidad asociada con el uso prolongado de corticosteroides. Por ello, los AINE han asumido un papel importante en el tratamiento a largo plazo de la artritis.[17]
Indicaciones
Los antiinflamatorios no esteroideos se indican en la medicina humana para el alivio sintomático de procesos crónicos o agudos caracterizados por dolor e inflamación, entre ellos:[13]
- Enfermedades reumatológicas:
- Artritis reumatoide
- Osteoartritis
- Atrofias inflamatorias: La indometacina a dosis de 25-50 mg c/8h suele ser la más efectiva aunque resulta altamente tóxica, por lo que otros AINE pueden dar alivio efectivo a estas inflamaciones crónicas.[48]
- Gota en estados agudos, con la excepción de tolmetina que resulta ineficaz en la gota.[17] Los AINE más recientes son tan efectivos como lo ha sido la más tóxica indometacina.[48]
- Dolor menstrual: ibuprofeno, ketoprofeno, ácido mefenámico y naproxen son los más recetados.[48]
- Dolores de cabeza y migrañas
- Dolor postquirúrgico
- Dolor de cáncer metastásico de hueso
- Dolor leve y moderado por inflamación o lesiones como torceduras y esguinces
- Fiebre
- Ileo paralítico
- Cólico nefrítico
También se indican en neonatología para recién nacidos con ductus arterioso persistente al cabo de 24 horas. En ginecología se indican AINE como el naproxen o el ácido mefenámico en las dosis usuales para reducir la pérdida de sangre en mujeres con metrorragia, aún aquellas con un dispositivo intrauterino.[48]
En odontología, los AINE se indican con frecuencia para el alivio del dolor leve o moderado de origen dental y posterior a intervenciones dentales. Los AINE también pueden prescribirse a pacientes con dolor crónico orofacial como en una sinovitis de la articulación temporomandibular. Aunque muy rara vez producen leucopenia o trombocitopenia, los AINE pueden causar irritación de la mucosa oral en algunos pacientes.[55]
Ventajas de los AINE:
- No producen depresión respiratoria
- No producen dependencia psíquica ni física
- No desarrollan tolerancia
- Efecto aditivo con los opiáceos: analgesia balanceada
Efectos adversos
El amplio uso de los antiinflamatorios no esteroideos significa un incremento en la prevalencia de los efectos adversos de estos medicamentos, que por lo general son muy seguros. Los efectos secundarios más frecuentes se relacionan con el sistema gastrointestinal y los riñones. Estos efectos son dependientes de la dosis administrada y, en muchos casos, lo suficientemente severos en ciertos grupos en la población, para poner en riesgo sus vidas. Se estima que entre un 10 y 20% de los pacientes que toman AINE presentan indigestión y se estima que los efectos adversos causados por la administración de AINE conllevan a más de 100 mil hospitalizaciones y unos 16 mil muertes cada año en los Estados Unidos.[56]
Gastrointestinales
El efecto adverso más frecuente asociado con el uso de los AINE se relaciona con la irritación directa o indirecta del tracto gastrointestinal. La mayoría de las veces es leve y no da síntomas, pero pueden ser muy graves. Algunos autores elevan su incidencia hasta el 10% de los usuarios, cifra que asciende aún más en los ancianos.[57] Las prostaglandinas juegan un rol importante en la protección de la mucosa gástrica, pues limitan la secreción ácida gástrica y estimulan la formación de mucus. Los AINE además de producir lesión local que depende del pH de la luz, con retrodifusión ácida a la mucosa, reducen el flujo sanguíneo de la mucosa, favoreciendo la lesión y afectan el funcionamiento de los neutrófilos induciendo la liberación de factores tisulares destructores. La seguridad de los AINE depende de varios factores como: la concentración sanguínea alcanzada, el tiempo que el antiinflamatorio permanece en la mucosa gástrica y edad de los pacientes. Los factores predisponentes para estos efectos son: edad mayor a 60 años, uso de corticoides y/o anticoagulantes, antecedente de úlcera, enfermedad grave (ya sea cardiovascular, hepática, renal o metabólica como la diabetes) tabaquismo, y uso de AINE muy ulcerógenos.
Los efectos secundarios gastrointestinales más frecuentes son: esofagitis, úlceras (siendo sus complicaciones más frecuentes hemorragia y perforación), gastroduodenitis, lesiones tópicas, indigestión y diarrea. La incidencia y el tipo de alteraciones difieren según el fármaco considerado. Para proteger la mucosa gástrica de los AINE el fármaco de elección es el misoprostol (debido a su origen prostaglandínico) o bien un inhibidor de la bomba de protones como el omeprazol, aunque a expensas de un mayor costo del tratamiento.
Los efectos adversos más frecuentes en niños que toman AINE son las náuseas, disminución del apetito y dolor abdominal. La gastritis y úlceras duodenales son menos frecuentes en niños que lo son en adultos.[58]
Cardiovascular y renales
Véase también: Hipertensión secundariaLa mayoría de los AINE presentan como efecto secundario un aumento de los niveles de la tensión arterial, tanto en sujetos sanos como en hipertensos previos.[38] Los mecanismos por los cuales ocurre esta hipertensión no están totalmente esclarecidos. Por lo general causan una elevación de 5 mmHg en la presión arterial, por lo que no deben ser administrados en pacientes con cifras tensionales altas.[48]
Al inhibir la COX1 se reduce la producción intrarrenal de prostaglandinas vasodilatadoras (prostaglandinaE2 y prostaglandinaI2), reduciendo el flujo sanguíneo renal y la tasa de filtración glomerular conllevando a la retención de sal y agua.[5] Los AINE suprimen la liberación de renina, y la cascada de activación formada por renina-angiotensina y aldosterona se interrumpe. Sin embargo la hipertensión se puede agravar por la mayor conversión extrarrenal de angiotensina I en angiotensina II y la liberación de aldosterona.[59] Igualmente, los AINE contrarrestan el efecto hipotensor de diuréticos, betabloqueantes, IECA o fármacos como el prazosín o la hidralacina porque parte de su acción hipotensora la ejercen estas sustancias a través de la liberación de prostaglandina renales.[1] Estas alteraciones se relacionan también con la hiperpotasemia que desencadenan estos fármacos pudiendo llegar a ser muy grave: la disminución de la secreción de aldosterona conlleva una menor secreción de potasio y, con ello, menor intercambio con el sodio que tiende a retenerse; de aquí se deriva también esa acción hipertensora de los antiinflamatorios no esteroideos.[25] La indometacina es uno de los AINE más relacionado con el efecto hiperpotasémico.
Al margen de los efectos hidroelectrolíticos, la inhibición de las prostaglandinas renales puede también tener como consecuencia lesiones orgánicas en el riñón, especialmente si se combinan con otros agentes nefrotóxicos: nefritis intersticial o necrosis papilar, que pueden desembocar en síndrome nefrótico o insuficiencia renal aguda.[60] Las lesiones son tan características que definen lo que se conoce como glomerulonefritis por AINE:
- Enfermedad renal previa
- Enfermedades cardiovasculares, cirrosis y ascitis, por la disminución del volumen circulante
- Diabetes
- Ancianos
La nefritis intersticial es más frecuente en mujeres y ancianos, y se debe a una reacción de hipersensibilidad que aumenta la permeabilidad vascular renal con la consiguiente proteinuria. En combinación con fenacetina, aspirina y/o paracetamol, por al menos 3 años, los AINE pueden causar nefropatía analgésica. Este trastorno es frecuente en pacientes que toman AINE para el alivio de dolores musculares, artritis o cefaleas crónicos.[48]
La acumulación de las evidencias demuestran que el uso de los AINE no salicilatos aumentan considerablemente el riesgo de infarto de miocardio e insuficiencia cardíaca en pacientes susceptibles, sin que se haya demostrado un efecto sobre la aparición de derrame cerebral.[61] [62]
Sistema Nervioso Central
Los AINE pueden causar, especialmente en niños, síntomas del sistema nervioso central como irritabilidad, cefaleas, mareos, acúfenos y somnolencia.[58] Con el ibuprofeno se puede observar disfunción cognitiva, irritabilidad y pérdida de memoria. El ibuprofeno puede causar una meningitis aséptica en pacientes con lupus eritematoso sistémico.[58]
Un efecto secundario subestimado es la fotosensibilidad caracterizada por la paradójica inflamación causada por estos antiinflamatorios en presencia de la luz solar. Los implicados más frecuentes son los derivados del ácido propiónico, aunque otros AINE como el piroxicam, diclofenaco y la benzidamina también han reportado este tipo de reacciones.
A pesar del riesgo de fotosensibilidad de algunos AINE, otros como el ketorolaco vienen en presentaciones oftálmicas para el alivio de la inflamación e irritación ocular causadas por alergias o después de una cirugía.[63]
Pleuropulmonar
Ciertos individuos manifiestan intolerancia a los AINE en la forma de broncoespasmo, rinitis con secreción nasal hialina profusa, urticaria generalizada, asma bronquial, edema laringea, hipotensión y choque. Aunque es raro en niños, el síndrome puede ocurrir hasta en un 25% de pacientes de edad media con asma o pólipos nasales, aún con dosis bajas de aspirina u otros AINE.[5]
Hepáticos
Coincidiendo con el uso sin prescripción médica, la incidencia de hepatotoxicidad por paracetamol está en aumento. En los Estados Unidos y en el Reino Unido, la toxicidad por paracetamol es la principal causa de insuficiencia hepática aguda, la mitad de los casos por administración accidental de una sobredosis.[64]
La hepatotoxicidad por ácido acetilsalicílico es dosis-dependiente. Las mujeres jóvenes con trastornos tales como fiebre reumática y artritis reumatoide juvenil parecen tener un riesgo más alto. La magnitud del riesgo de hepatotoxicidad clínicamente relevante en los usuarios de ácido acetilsalicílico no se conoce. Se han descrito elevaciones transitorias de las enzimas hepáticas en la mitad de los pacientes que reciben dosis antiinflamatorias completas de ácido acetilsalicílico. La dipirona no parece provocar hepatotoxicidad.
Efectos hematológicos
Pueden causar disminución de la agregación plaquetaria, sólo el AAS inhibe en forma irreversible a la ciclooxigenasa, por lo que la prolongación de tiempo de sangría es considerable y dosis dependiente, los otros AINE tienen efectos reversibles. Este efecto puede ser beneficioso en el postoperatorio, sobre todo en los que pueden inducir tromboembolismos e isquemia miocárdica con concentraciones aumentadas de tromboxano A2 (TXA2). El efecto sobre el sangrado intraoperatorio es controvertido, a altas dosis interfiere con la síntesis de protrombina.
Además pueden producir agranulocitosis, neutropenia y anemia siendo mayor su frecuencia en niños o con el uso de dipirona.[58]
Otros efectos secundarios
Reacciones de tipo urticaria, edema angioneurótico, sinagesia, hipotensión, shock, síncope, las reacciones de tipo alérgico no son cruzadas entre los diferentes tipos de AINE.
Los AINE, con la excepción del paracetamol, no son recomendados durante el embarazo, en particular durante el tercer trimestre. Aunque no son teratógenos directos, pueden causar cierre prematuro del ductus arterioso y ciertos trastornos renales. La aspirina se ha usado junto con heparina en mujeres embarazadas con anticuerpos antifosfolípidos.
El primer estudio de casos y controles que demostró una asociación entre el síndrome Reye y los salicilatos en niños con enfermedad vírica previa, especialmente resfriado y varicela, apareció en 1980. Esta se siguió de tres estudios adicionales de casos y controles publicados en 1982. En todos estos estudios se encontró una fuerte asociación y más del 95 % de los casos habían estado expuestos a los salicilatos...
Contraindicaciones
- Ancianos: Los AINE deben administrarse con cautela a los ancianos por riesgo de efectos adversos graves y muerte.
- Alergia: están contraindicados si el paciente refiere antecedentes de hipersensibilidad al ácido acetilsalicílico o a cualquier otro AINE, en crisis asmáticas, angioedema, urticaria o rinitis provocadas por el ácido acetilsalicílico o cualquier otro AINE.
- Embarazo y lactancia: Durante el embarazo puede producir malformaciones fetales, como por ejemplo el cierre prematuro del ductus arteriosus fetal. Es aconsejable no usar durante los últimos meses.[65] [66]
- Defectos de la coagulación.[66]
- Alteraciones de la función renal: debe reducirse la dosis al mínimo posible y controlar la función renal
- Alteraciones de la función cardíaca. Todos los AINE están contraindicados en la insuficiencia cardíaca grave. Los inhibidores selectivos de la ciclooxigenasa-2 están contraindicados en la enfermedad cardíaca isquémica, la enfermedad cerebrovascular, la enfermedad arterial periférica y la insuficiencia cardíaca congestiva grave o moderada.[57]
- Antecedentes de patología gástrica: los AINE no selectivos están contraindicados en los pacientes con úlcera péptica previa o activa, así como los inhibidores selectivos de la ciclooxigenasa-2 en aquellos con úlcera péptica activa.
- Uso concomitante de corticoides.[66]
Uso veterinario
Los AINE se pueden utilizar en veterinaria para el tratamiento de las condiciones que causan dolor crónico o persistente. Se indican también con frecuencia para el manejo del dolor agudo y posoperatorio, siempre que la presión arterial, la coagulación y los parámetros gastrointestinales sean normales. Sin embargo, en veterinaria, los opioides son la base del tratamiento del dolor agudo y quirúrgico.[67] El ácido meclofenámico se encuentra disponible en tabletas masticables para administración en rumiantes, por lo que se puede mezclar con la comida regular del animal.[19]
Los caballos tienen particular predisposición a reacciones adversas renales por la administración de ciertos AINE que otras especies de animales domésticos y tiende a ser reversible.[68] Este problema es acuciante en otras especies, como el buitre. Se ha reportado que el uso veterinario de diclofenaco ha llevado a un agudo decrecimiento en la población de buitres en el subcontinente indio, hasta de un 95% en ciertas áreas. El mecanismo de la muerte es probablemente la insuficiencia renal. Los buitres comen los restos de animales domésticos tratados veterinariamente con diclofenaco, y se envenenan debido al elemento químico acumulado. Durante la reunión de la National Wildlife Board en marzo de 2005, el gobierno de India anunció que espera terminar con el uso de diclofenaco en animales. El candidato para reemplazar al diclofenaco es el Meloxicam.[69]
El acetaminofen es altamente tóxico para gatos debido a las lesiones oxidativas causadas por metabolitos del medicamento sobre los glóbulos rojos del animal. Por ello, no existe una dosis segura de administración de acetaminofen en gatos, reportándose intoxicaciones y muerte en dosis hasta de 10 mg/kg de peso.[70]
Véase también
- Analgésico
- Antipirético
- Anexo:Código ATC M
- Colchicina
- Esteroideos
- Analgesia postoperatoria
- Reumatismo palindrómico
Notas
a. ↑ Estudios relacionados:
- Se realizó un estudio en 6989 sujetos sin trastornos cognoscitivos, donde se definieron 4 categorías excluyente en cuanto al uso de AINE: 1) no usó de AINE, 2) corto uso de AINE (1mes o menos de uso acumulativo), 3) uso intermedio de AINE (más de 1 mes pero < de 24 meses) y 4) uso prolongado (más de 24 meses de uso); como resultado, 394 desarrollaron demencia y de los cuales 293 reunían criterios de Enfermedad de Alzheimer, 56 de Demencia Vascular y 45 otros tipos de demencia. Este meticuloso estudio nos sugiere evidencia de que existe una asociación inversa entre el uso crónico de AINE y la aparición de EA. Además posee como fuerza metodológica, teniendo siempre como limitante el hecho de ser un estudio observacional, el haber seguido a casi 7000 pacientes por un período de casi ocho años. Los resultados muestran una relación lineal con respecto al tiempo de duración del uso de AINE y prevención de la aparición de la enfermedad, llegando a un riesgo relativo (RR) de 0.20 para aquellos que usaron AINE por lo menos por dos años.
- Un estudio australiano en 163 pacientes con demencia 78 con enfermedad de Alzheimer, 45 con demencia vascular y 40 con otros tipos de demencia y 373 controles, investigó el empleo de 50 medicamentos diferentes y encontraron una relación inversa entre la enfermedad de Alzheimer y el uso de AINE (incluida la aspirina) y los inhibidores de la enzima convertidora de angiotensina.
Las asociaciones más sólidas se encontraron con el empleo concomitante de AINE y aspirina, de dos AINE y de dos bloqueadores H2. Se postula que el empleo de AINE en enfermedad de Alzheimer mejora el desempeño cognoscitivo pero no detiene los cambios histológicos. Sin embargo el mecanismo del efecto de este grupo de fármacos en la enfermedad de Alzheimer es complejo y desafortunadamente no está totalmente aclarado.
b. ↑ Se evaluó en este estudio clínico controlado con placebo el empleo de dos dosis distintas de celecoxib y un grupo placebo en 77 pacientes. Después de seis meses de seguimiento se mostró una reducción en el número de pólipos del 28% en el grupo de dosis alta de celecoxib y del 30% en la suma del diámetro de los pólipos. El grupo en dosis bajas de celecoxib redujo el número de pólipos en un 11.9% y el diámetro de los mismo en un 14.6%, mientras el placebo lo hizo un 4.5% y un 4.9% en esas dos variables. No se encontraron diferencias estadísticamente significativas entre el grupo de dosis bajas de celecoxib y el placebo. Sin embargo, la incidencia de efectos secundarios fue similar entre los grupos, por lo que en la administración prolongada de AINE debe de tomarse en cuenta la gran cantidad de reacciones adversas que se pueden presentar.
Referencias
- ↑ a b c d Clive P. Page, Michael J. Curtis, Morley Sutter, Michael Walker, Brian Hoffman. Farmacología integrada (en español). Publicado por Elsevier España, 1998. ISBN 84-8174-340-2
- ↑ a b c d e James S. Dawson, Alfonso Moreno González, Magali N. F. Taylor, Peter J. W. Reide. Lo esencial en farmacología (en español). Publicado por Elsevier España, 2005; pág 55-56. ISBN 84-8174-694-0
- ↑ Philippe Maslo, Raphaël Olle Cervera, Nuria Casals. Las dolencias de la espalda (en español). Publicado por Editorial Paidotribo, 2001. ISBN 84-8019-266-6
- ↑ Mosby Staff. Diccionario Mosby Pocket de Medicina, Enfermeria y Ciencias de la salud (en español). Publicado por Elsevier España, 2004. ISBN 84-8174-675-4
- ↑ a b c d e f g h Hardman, Joel G.; Limbird, Lee E.; Goodman Gilman, Alfred. (1996). «Capítulo 27: Analgésicos-antipiréticos, antiinflamatorios y fármacos que se utilizan en el tratamiento de la gota.». Goodman & Gilman, las bases farmacológicas de la terapéutica. (9 edición). México, D. F.: Ed. McGraw-Hill Interamericana. ISBN 0-07-026266-7.
- ↑ a b c John McMurry. Química Orgánica (en español). Publicado por Cengage Learning Editores, 2005. ISBN 970-686-354-0
- ↑ Reacción de Kolbe-Schmitt:
- Hermann Kolbe (1860). «Ueber Synthese der Salicylsäure». Annalen der Chemie und Pharmacie 113 (1): pp. 125–127. doi:.
- R. Schmitt (1885). «Beitrag zur Kenntniss der Kolbe'schen Salicylsäure Synthese». Journal für Praktische Chemie 31 (1): pp. 397–411. doi:.
- A. S. Lindsey and H. Jeskey (1957). «The Kolbe-Schmitt Reaction». Chem. Rev. 57 (4): pp. 583–620. doi:. (Review)
- Z Markovic, JP Engelbrecht, S Markovic (2002). «Theoretical Study of the Kolbe-Schmitt Reaction Mechanism». Z. Naturforsch. 57 (9-10): pp. 812–818. ISSN 0932-0784. http://www.znaturforsch.com/aa/v57a/s57a0812.pdf.
- ↑ Trabajos de John R. Vane sobre prostaglandinas:
- «Inhibition of prostaglandin biosynthesis as the mechanism of analgesia of aspirin-like drugs in the dog knee joint.», Eur. J. Pharmacol. 31 (2): 250-60, 1975, 1975 Apr, PMID:1149792, http://www.ncbi.nlm.nih.gov/pubmed/1149792
- «Further experiments to establish that the analgesic action of aspirin-like drugs depends on the inhibition of prostaglandin biosynthesis.», Br. J. Pharmacol. 47 (3): 629P-630P, 1973, 1973 Mar, PMID:4199867, http://www.ncbi.nlm.nih.gov/pubmed/4199867
- «Indomethacin and aspirin abolish prostaglandin release from the spleen.», Nature New Biol. 231 (25): 237-9, 1971, 1971 Jun 23, PMID:5284362, http://www.ncbi.nlm.nih.gov/pubmed/5284362
- «Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs.», Nature New Biol. 231 (25): 232-5, 1971, 1971 Jun 23, PMID:5284360, http://www.ncbi.nlm.nih.gov/pubmed/5284360
- ↑ Autobiografía: John R. Vane - The Nobel Prize in Physiology or Medicine 1982 (en inglés). Nobel Foundation. Último acceso 16 de diciembre de 2008.
- ↑ Merrill Goozner. The $800 Million Pill (en inglés). Publicado por University of California Press, 2004; pág 224. ISBN 0-520-24670-5
- ↑ a b González Pérez, R. Test de provocación nasal con acetil-salicilato de lisina: nuevo método diagnóstico en la intolerancia a anti-inflamatorios no esteroideos Universidad de La Laguna. ISBN 84-7756-624-0
- ↑ a b c d e f g h Jesus Florez, Juan Antonio Armijo, África Mediavilla. Farmacología humana (en español). Publicado por Elsevier España, 2004; pág 375-376. ISBN 84-458-1290-4
- ↑ a b c d e f Silvia Castells Molina, S. Castells, Margarita Hernández Pérez. Farmacología en enfermería (en español). Publicado por Elsevier España, 2007; Capítulo 14. ISBN 84-8174-993-1
- ↑ a b c d e f L. Torres, Julián Elorza. Medicina del dolor Publicado por Elsevier España, 1997; pág 73. ISBN 84-458-0561-4
- ↑ Carol David, Gillian Margaret Lloyd. Rehabilitación reumatologica (en inglés). Publicado por Elsevier España, 2000; pág 25. ISBN 84-8174-488-3
- ↑ a b Heinz Lüllmann, Klaus Mohr. Atlas de Farmacología (en español). Publicado por Elsevier España, 2004. ISBN 84-458-1160-6
- ↑ a b c d e f g Katzung, Bertram G. (2007). «Chapter 36. Nonsteroidal Anti-Inflammatory Drugs, Disease-Modifying Antirheumatic Drugs, Nonopioid Analgesics, & Drugs Used in Gout». Basic & Clinical Pharmacology (9 edición). McGraw-Hill. ISBN 0071451536.
- ↑ TORRES, L. M., MARTINEZ-PENUELA, F., CASTILLA, G. et al. Estudio Observacional sobre el dolor Postoperatorio leve o moderado: Evaluación del tratamiento con Paracetamol IV. Estudio EOPEP. Rev. Soc. Esp. Dolor. [online]. 2008, vol. 15, no. 4 [citado 2008-12-27], pp. 219-227. Disponible en: <http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1134-80462008000400003&lng=es&nrm=iso>. ISSN 1134-8046.
- ↑ a b c Adams, H. Richard (2001). «Capítulo 22: The analgesic, antipyretic, anti-inflammatory drugs.» (en inglés). Veterinary Pharmacology and Therapeutics. Blackwell Publishing. ISBN 0813817439. http://books.google.com/books?id=2CUbc0RXvb8C. Consultado el 28 de diciembre de 2008.
- ↑ a b c d Kenneth L. Melmon, Howard F. Morrelli, S. George Carruthers. Melmon and Morrelli's Clinical Pharmacology (en inglés) Publicado por McGraw-Hill Professional, 2000. ISBN 0-07-105406-5
- ↑ a b «Presentación farmacológica y metabolismo de los salicilatos» (en inglés). Consultado el 22 de diciembre de 2008.
- ↑ Bataller Sifre, Ramón; Balaguer Martínez, José V (2004). «Intoxicaciones por AINE, metil-xantinas, fármacos cardiovasculares». Toxicología Clínica. Universitat de València. ISBN 843706015X. «Véase página 140»
- ↑ Muriel Villoria, C. «Farmacología de los analgésicos no opiáceos». Dolor crónico. Arán. ISBN 8496881210. «Véase página 167»
- ↑ Piola, Juan Carlos (2003). «Salicilatos». Guía práctica para el monitoreo de fármacos y drogas de abuso. Universidad Nac. del Litoral. ISBN 9875082104. «Véase página 51»
- ↑ a b Flórez, Jesús; Armijo, Juan Antonio; Mediavilla, África (2004). «Fármacos analgésicos, antitérmicos y antiinflamatorios no esteroideos. Antiartríticos.». Farmacología humana (Cuarta edición). Masson. ISBN 8445812904. «Véanse páginas 383 y 387»
- ↑ Bird y col., H. A. (1983). «A phenylbutazone dose-finding study in rheumatoid arthritis» (en inglés). European Journal of Clinical Pharmacology 24 (6). DOI: 10.1007/BF00607086. http://www.springerlink.com/content/x52386123328v209/. Consultado el 20 de diciembre de 2008.
- ↑ Manuchair S. Ebadi. Desk Reference of Clinical Pharmacology (en inglés). Publicado por CRC Press, 2007;pág 534. ISBN 1-4200-4743-4
- ↑ a b c Olkkola, KT; Brunetto AV, Mattila MJ (febrero 1994). «Pharmacokinetics of oxicam nonsteroidal anti-inflammatory agents» (en inglés). Clin Pharmacokinet 26 (2): pp. 107-120. PMID 8162655. http://www.ncbi.nlm.nih.gov/pubmed/8162655. Consultado el 20 de diciembre de 2008.
- ↑ Luján, M; López-Martínez E, Guajardo R, Castañeda JL et al. (2001). «Farmacología de los COXIB. Especificidad vs selectividad» (en español). Rev Med Hosp Gen Mex 64 (Supl 1): pp. 13-15. http://www.medigraphic.com/espanol/e-htms/e-h-gral/e-hg2001/e-hgs01-1/em-hgs011c.htm. Consultado el 20 de diciembre de 2008.
- ↑ Lastair, A.; Wood JJ (2001). «The Coxibs, Selective Inhibitors of Cyclooxygenase-2» (en inglés, pdf). N Engl J Med 345 (6). http://nerve.neurology.unc.edu/teaching_files/Cox2-NEJM.pdf. Consultado el 20 de diciembre de 2008.
- ↑ a b National Institutes of Health. ponstel (Mefenamic Acid) capsules (artículo completo disponible en inglés). Último acceso 19 de diciembre de 2008.
- ↑ Basado en la difracción de neutrones obtenido por N. Shankland, C. C. Wilson, A. J. Florence and P. J. Cox (1997). Refinement of Ibuprofen at 100K by Single-Crystal Pulsed Neutron Diffraction (en inglés). Acta Crystallographica Section C 53: 951-954. DOI:10.1107/S0108270197003193.
- ↑ John David Loeser, John J. Bonica, Stephen H. Butler, C. Richard Chapman, Dennis C. Turk . Bonica's Management of Pain (en inglés). Publicado por Lippincott Williams & Wilkins, 2001. ISBN 0-683-30462-3
- ↑ J. Mazarío,J; Solano, R.E. y Herrero J.F.El efecto analgésico agudo de los antiinflamatorios no esteroideos se debe al bloqueo de la ciclooxigenasa-1 Rev.Soc.Esp.Dolor, 7: 503-510, 2000
- ↑ Buritova J, Honoré P, Besson JM. Ketoprofen produces profound inhibition of spinal c-Fos protein expression resulting from an inflammatory stimulus but not from noxious heat (en inglés). Pain. 1996 Oct;67(2-3):379-89. PMID: 8951933
- ↑ Hollis JH, Evans AK, Bruce KP, Lightman SL, Lowry CA. Lipopolysaccharide has indomethacin-sensitive actions on Fos expression in topographically organized subpopulations of serotonergic neurons (en inglés). Brain Behav Immun. 2006 Nov;20(6):569-77. Epub 2006 Mar 22. PMID: 16554144
- ↑ J. Buritova y J. M. Besson. Potent anti-inflammatory/analgesic effects of lornoxicam in comparison to other nsaids: A c-fos study in the rat (en inglés). Inflammopharmacology. 1997;5(4):331-41. PMID: 17657612
- ↑ a b Pérez Ruiz, A; López Mantecón, AM; Grau León, I (2002). «Antiinflamatorios no esteroideos (AINE). Consideraciones para su uso estomatológico» (en español). Rev Cubana Estomatol 29 (2). http://bvs.sld.cu/revistas/est/vol39_2_02/Est04202.htm.
- ↑ Gustavo G Vivancos, Carlos A Parada y Sérgio H Ferreira. Opposite nociceptive effects of the arginine/NO/cGMP pathway stimulation in dermal and subcutaneous tissues (artículo completo disponible en inglés). British Journal of Pharmacology (2003) 138, 1351–1357. doi:10.1038/sj.bjp.0705181
- ↑ Pierre Hardy y col. A Major Role for Prostacyclin in Nitric Oxide–Induced Ocular Vasorelaxation in the Piglet (artícluo completo disponible en inglés). Circulation Research. 1998;83:721-729. Último acceso 17 de diciembre de 2008.
- ↑ a b William N. Kelley, Edward D. Harris, Shaun Ruddy. Tratado de Reumatología (en español). Publicado por Elsevier España. ISBN 84-8174-840-4
- ↑ Caballero Callejas, J. Indicaciones de los AINE vía parenteral en dolor agudo. Supuestos prácticos Sitio Web Oficial de la Sociedad Española del Dolor: V Reunión de la sociedad del Dolor (Granada 2001). Último acceso 15 de diciembre de 2008.
- ↑ Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (June 2004). «The importance of neuritic plaques and tangles to the development and evolution of AD». Neurology 62 (11): pp. 1984–9. PMID 15184601.
- ↑ Ohnishi S, Takano K (March 2004). «Amyloid fibrils from the viewpoint of protein folding». Cell. Mol. Life Sci. 61 (5): pp. 511–24. doi:. PMID 15004691.
- ↑ Alan F. Schatzberg. Tratado de psicofarmacología (en español). Publicado por Elsevier España, 2006; pág 887. ISBN 84-458-1426-5
- ↑ Ruy Pérez Tamayo, Octavio Rivero Serrano, Miguel Tanimoto. El ejercicio de la medicina en la segunda mitad del siglo XX (en español). Publicado por Siglo XXI, 2005; pág. 31. ISBN 968-23-2583-8
- ↑ John W. Baynes, Marek H. Dominiczak. Bioquimica médica (en español). Publicado por Elsevier España, 2005; pág 608. ISBN 84-8174-866-8
- ↑ a b c d e f g Stephen J. McPhee, Maxine A. Papadakis, Lawrence M. Tierney. Current Medical Diagnosis and Treatment 2008. Publicado por McGraw-Hill Medical; edición 47. ISBN 0-07-149430-8
- ↑ Steinbach G y col. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis (artículo completo disponible en inglés). N Engl J Med. 2000 Jun 29;342(26):1946-52. Último acceso 18 de diciembre de 2008.
- ↑ Mark A Scheper, Nikolaos G Nikitakis, Risa Chaisuparat, Silvia Montaner, y John J Sauk. Sulindac Induces Apoptosis and Inhibits Tumor Growth in vivo in Head and Neck Squamous Cell Carcinoma (artículo completo disponible en inglés). Neoplasia. 2007 March; 9(3): 192–199.
- ↑ [MedlinePlus-Medicinas] (abril de 2004). «Sulindac» (en español). Enciclopedia médica en español. Consultado el 18 de diciembre de 2008. «El sulindac también a veces se usa para reducir el número de pólipos (crecimientos anormales) en el colon (intestino grueso) y en el recto, en los pacientes con poliposis adenomatosa familiar (una condición en la que se forman cientos o miles de pólipos en el colon y se puede desarrollar cáncer).».
- ↑ Dabit Arzamendia, Xavier Freixaa, Maria Puiga y Magda Herasa. Mecanismo de acción de los fármacos antitrombóticos (artículo completo disponible en español). Rev Esp Cardiol 2006; 6: 2 - 10. ISSN : 1579-2242
- ↑ Julian, D G; D A Chamberlain, S J Pocock (24-09-1996). «A comparison of aspirin and anticoagulation following thrombolysis for myocardial infarction (the AFTER study): a multicentre unblinded randomised clinical trial». BMJ (British Medical Journal) 313 (7070): pp. 1429–1431. PMID 8973228. http://www.bmj.com/cgi/content/full/313/7070/1429.
- ↑ Krumholz, Harlan M.; Martha J. Radford, Edward F. Ellerbeck, John Hennen, Thomas P. Meehan, Marcia Petrillo, Yun Wang, Timothy F. Kresowik, Stephen F. Jencks (15-11-1995). «Aspirin in the Treatment of Acute Myocardial Infarction in Elderly Medicare Beneficiaries : Patterns of Use and Outcomes». Circulation 92 (10): pp. 2841–2847. PMID 7586250. http://circ.ahajournals.org/cgi/content/abstract/92/10/2841.
- ↑ Jośe Javier Echeverría García, American Dental Association. Terapeutica dental (en español). Publicado por Elsevier España, 2003; pág 94-95. ISBN 84-458-1209-2
- ↑ Green GA. Understanding NSAIDs: from aspirin to COX-2 (en inglés). Clin Cornerstone. 2001;3(5):50-60.
- ↑ a b Prithvi Raj, Tratamiento practico del dolor: Elsevier España, 2001 3ª edición ISBN 84-8174-552-9 Disponible en [1]
- ↑ a b c d Richard E. Behrman, Robert M. Kliegman, Hal B. Jenson. Nelson Tratado de Pediatria (en español). Publicado por Elsevier España, 2004; pág 797. ISBN 84-8174-747-5
- ↑ Valsecia, M.E.; Malgor, L.A. Farmacología de los eicosanoides. Prostaglandinas y productos relacionados. Disponible en [2]
- ↑ Albornoz A JC. Efecto Secundario de los AINE. Revisión . Revista de la Sociedad Médico Quirúrgica del Hospital de Emergencia Pérez de León. 1997;28(1):48-54. Disponible en [3]
- ↑ Patricia M Kearney y col. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials (artículo completo disponible en inglés). BMJ 2006;332:1302-1308 (3 de junio), doi:10.1136/bmj.332.7553.1302. Último acceso 18 de diciembre de 2008.
- ↑ John Page, David Henry. Consumption of NSAIDs and the Development of Congestive Heart Failure in Elderly Patients (artículo completo disponible en inglés). Arch Intern Med. 2000;160:777-784. Último acceso 18 de diciembre de 2008.
- ↑ [MedlinePlus] (octubre de 2000). «Ketorolaco oftálmico» (en español). Enciclopedia médica en español. Consultado el 19 de diciembre de 2008.
- ↑ [Today] (diciembre de 2005). «Acetaminophen: Most common cause of acute liver failure in US» (en inglés). Medscape Medical News. Consultado el 27 de diciembre de 2008.
- ↑ Analgésicos antiinflamatorios no esteroideos. Disponoble en [4]
- ↑ a b c González Sotomayor, J; Dagnino Sepúlveda, J. Analgésicos no narcóticos. Boletín Esc. de Medicina, Pontificia Universidad Católica de Chile 1994; 23: 164-169 Disponible en [5]
- ↑ Larry Ford, Richard B. Ford, Elisa M. Mazzaferro, Robert Warren Kirk, Stephen I. Bistner. Kirk y Bistner- Urgencias en Veterinaria (en inglés). 8 edición. Publicado por Elsevier España, 2007; pág 71-72. ISBN 84-8174-999-0
- ↑ Timothy H. Ogilvie. Large Animal Internal Medicine (en inglés). Publicado por Blackwell Publishing, 1998; pág 357. ISBN 0-683-18033-9
- ↑ Ministry of Environment & Forests -Government of India (2006)
- ↑ Allen, Andrew L. (junio 2003). «The diagnosis of acetaminophen toxicosis in a cat» (en inglés). Can Vet J. 44 (6): pp. 509-510. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=12839249. Consultado el 22 de diciembre de 2008.
Bibliografía
- Revistas
- Boyce, Eric G., Takiya, Liza. Nonsteroidal anti-inflammatory drugs: Review of factors guiding formulary selection
- De La Biblioteca Cochrane Plus, número 4, 2007. Oxford, Update Software Ltd. Fármacos antiinflamatorios no esteroideos para la dismenorrea primaria (Revisión Cochrane traducida)
- Fu, J. ; Masferrer, J; Seibert, K.; Raz, A; Needleman, p. The Introduction and Suppression of Prostaglandin H2 Syntethase (Ciclooxygenase) in Human Monocites. J Clin Inves 1990; 86:1375-9.
Herschman, h.p. Prostaglandin Syntethase 2. history and AINE 1996; 1299:125-40.
- J Marjoribanks et al. Nonsteroidal anti-inflammatory drugs for primary dysmenorrhoea (Cochrane Review). In: the Cochrane Library, Issue 4, 2003
- M. R. Moreno Brea y J. A. Micó, Inhibidores de la COX-2: Mecanismo de acción, Revista Sedolor, Reunión Científica de la Sociedad Española del Dolor, España, 2000, pp. 3-6.
- Martín Villa, Isabel, Salgueiro Vásques, M. Esther Dispensación active de antiinflamatorios no esteroideas con receta
- Nuñez Cámara C., Ventura López P., Martínez Escudero J.A AINE clásicos e inhibidores selectivos de la COX-2
- Rivera-Ordóñez Arizbe, AINE: Su mecanismo de acción en el Sistema Nervioso Central, Revista Mexicana de Anestesiología, 2006, Volumen 29, Número 1, pp. 36-40.
- Libros
- Acosta Mejía, M, Manual clínico de farmacología práctica. JGH editores, primera edición, 2000.
- De la Torre Mr, Rodríguez Mr. Vías de administración y protocolos. En: De la Torre R. “Guía Práctica del Dolor Agudo Postoperatorio”. Ed. Arán S.A. 2001; 99-118
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Antiinflamatorio no esteroideo. Commons
Wikimedia Commons alberga contenido multimedia sobre Antiinflamatorio no esteroideo. Commons- Rofecoxib (en inglés). Información del protocolo legal sobre el Rofecoxib.
- Rofecoxib (En español). Ficha técnica de la Agencia Española del Medicamento
Categorías:- Analgésicos
- Antiinflamatorios no esteroideos
- Código ATC M
Wikimedia foundation. 2010.