- Número de Avogadro
-
Valores de NA[1] Unidades 6.022 141 79(30)×1023 mol−1 2.731 597 57(14)×1026 lb-mol.−1 1.707 248 479(85)×1025 oz-mol.−1 Para más detalles, ver Terminología y unidades más adelante. En química y en física, la constante de Avogadro (símbolos: L, NA) es el número de entidades elementales (normalmente átomos o moléculas) que hay en un mol, esto es (a partir de la definición de mol), el número de átomos de carbono contenidos en 12 gramos de carbono-12.[2] [3] Originalmente se llamó número de Avogadro.
En 2006, la CODATA recomendó este valor de:[1]donde (30) se refiere a la incertidumbre estándar de la constante, concretamente al valor 0.000 000 30×1023 mol−1. La constante de Avogadro debe su nombre al científico italiano de principios del siglo XIX Amedeo Avogadro, quien, en 1811, propuso por primera vez que el volumen de un gas (a una determinada presión y temperatura) es proporcional al número de átomos, o moléculas, independientemente de la naturaleza del gas.[4] El físico francés Jean Perrin propuso en 1909 nombrar la constante en honor de Avogadro.[5] Perrin ganaría en 1926 Premio Nobel de Física, en gran parte por su trabajo en la determinación de la constante de Avogadro mediante varios métodos diferentes.[6]
El valor de la constante de Avogadro fue indicado en primer lugar por Johann Josef Loschmidt que, en 1865, estimó el diámetro medio de las moléculas en el aire por un método equivalente a calcular el número de partículas en un volumen determinado de gas.[7] Este último valor, la densidad numérica de partículas en un gas ideal, que ahora se llama en su honor constante de Loschmidt, es aproximadamente proporcional a la constante de Avogadro. La conexión con Loschmidt es la raíz del símbolo L que a veces se utiliza para la constante de Avogadro, y la literatura en lengua germana puede referirse a ambas constantes con el mismo nombre, distinguiéndolas solamente por las unidades de medida.[8]
Contenido
Terminología y unidades
Propusieron originalmente el nombre de "número de Avogadro" (N) para referirse al número de moléculas en una molécula-gramo de oxígeno (exactamente 32 gramos de oxígeno, de acuerdo con las definiciones del periodo),[5] y este término es aún ampliamente utilizado, especialmente en la introducción de los trabajos.[9] El cambio de nombre a "constante de Avogadro" (NAA) vino con la introducción del mol como una unidad básica separada dentro del Sistema Internacional de Unidades (SI) en 1971,[10] que reconoció la cantidad de sustancia como una unidad independiente.[11] Con este reconocimiento, la constante de Avogadro ya no es un número puro, sino una magnitud física, asociada con una unidad de medida, la inversa de mol (mol- 1) en unidades SI.[11] El cambio de nombre de la forma posesiva "de Avogadro" a la forma nominativa "Avogadro" es un cambio general en práctica desde la época de Perrin para los nombres de todas las constantes físicas.[1] En efecto, la constante es nombrada en honor de Avogadro: no se refiere al propio Avogadro, y habría sido imposible medirla durante la vida de Avogadro.
Si bien es raro el uso de unidades de cantidad de sustancia que no sean el mol, la constante de Avogadro también se puede definir en unidades como la libra-mol (lb-mol.) y el onza-mol (oz -mol.).
- NA = 2.731 597 57(14) . 1026 lb-mol.−1 = 1.707 248 479(85) . 1025 oz-mol.−1
Relaciones físicas adicionales
Debido a su papel como factor de escala, la constante de Avogadro establece un vínculo entre una serie de útiles constantes físicas cuando nos movemos entre la escala atómica y la escala macroscópica. Por ejemplo, establece la relación entre:
- la constante de los gases R y la constante de Boltzmann kB:
- la constante de Faraday F y la carga elemental e:
- en C [[mol−1]]
La constante de Avogadro también entra en la definición de la unidad de masa atómica (u):
donde Mu es la masa molar.
Medida
Coulombimetría
El primer método preciso de medir el valor de la constante de Avogadro se basaba en la coulombimetría. El principio consiste en medir la constante de Faraday,F, que es la carga eléctrica transportada por un mol de electrones, y dividir por la carga elemental,e , para obtener la constante de Avogadro.
El experimento clásico es el de Bowers y Davis en el NIST,[12] y se basa en la disolución del metal plata del ánodo de una celda electrolítica, al pasar una corriente eléctrica constante I durante un tiempo conocido t . Si m es la masa de plata perdida por el ánodo y Ar el peso atómico de la plata, entonces la constante de Faraday viene dada por:
Los investigadores del NIST desarrollaron un ingenioso método para compensar la plata que se perdía desde el ánodo por razones mecánicas, y realizó un análisis isotópico de su plata para determinar el peso atómico apropiado. Su valor para la convencional constante de Faraday es: F90 = 96485,309 C/mol, que corresponde a un valor para la constante de Avogadro de 6,0221367·1023 mol−1: ambos valores tienen una incertidumbre estándar relativa de 1.3 . 10-6.
Método de la masa de electrones (CODATA)
El valor CODATA para la constante de Avogadro[13] se determina a partir del cociente entre la masa molar del electrón Ar(e), Mu y la masa en reposo del electrón me:
La "masa atómica relativa" del electrón, Ar(e), es una cantidad medible directamente, y la constante masa molar Mu, es una constante definida en el sistema SI. La masa en reposo del electrón, sin embargo, se calcula a partir de otras constantes medidas:[13]
Como puede observarse en los valores de la tabla CODATA2006, el principal factor limitante en la precisión con la que se conoce el valor de la constante de Avogadro es la incertidumbre en el valor de la constante de Planck, ya que todas las demás constantes que contribuyen al cálculo se conocen con mucha más precisión.
Constante Símbolo Valor 2006 CODATA Incertidumbre estándar relativa Coeficiente de correlación
con NAMasa atómica relativa del electrón Ar(e) 5.485 799 0943(23) . 10–4 4.2 . 10–10 0.0082 Masa molar Mu 0.001 kg/mol definida — Constante de Rydberg R∞ 10 973 731.568 527(73) m−1 6.6 . 10–12 0.0000 Constante de Planck h 6.626 068 96(33) . 10–34 Js 5.0 . 10–8 –0.9996 Velocidad de la luz c 299 792 458 m/s definida — Constante de estructura fina α 7.297 352 5376(50) . 10–3 6.8 . 10–10 0.0269 Constante de Avogadro NA 6.022 141 79(30) . 1023 mol−1 5.0 . 10–8 1 Método de la densidad del cristal por rayos X
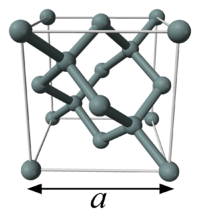 Modelo de bolas y varillas de la celda unidad de silicio. Experimentos de difracción de rayos X pueden determinar el parámetro de la celda,a, que a su vez puede utilizarse para calcular el valor de la constante de Avogadro.
Modelo de bolas y varillas de la celda unidad de silicio. Experimentos de difracción de rayos X pueden determinar el parámetro de la celda,a, que a su vez puede utilizarse para calcular el valor de la constante de Avogadro.
Un método moderno para calcular la constante de Avogadro es utilizar la relación del volumen molar, Vm, al volumen de la celda unidad, Vcell, para un cristal sencillo de silicio:[14]
El factor de ocho se debe a que hay ocho átomos de silicio en cada celda unidad.
El volumen de la celda unidad se puede obtener por cristalografía de rayos X; como la celda unidad es cúbica, el volumen es el de un cubo de la longitud de un lado (conocido como el parámetro de la celda unidad, a). En la práctica, las medidas se realizan sobre una distancia conocida comod220(Si) que es la distancia entre los planos indicada por el índice de Miller {220}, y es igual a a/√8. El valor CODATA2006 para d220(Si) es 192.015 5762(50) pm, con una incertidumbre relativa de 2.8 . 10–8, correspondiente a un volumen de celda unidad de 1.601 933 04(13) . 10–28 m3.
La composición isotópica proporcional de la muestra utilizada debe ser medida y tenida en cuenta. El silicio presenta tres isótopos estables - 28Si, 29Si, 30Si - y la variación natural en sus proporciones es mayor que otras incertidumbres en las mediciones. La Masa atómica Ar para un cristal sencillo, puede calcularse ya que las masas atómicas relativas de los tres núclidos se conocen con gran exactitud. Esto, junto con la medida de la densidad ρ de la muestra, permite calcular el volumen molarVm que se encuentra mediante:
dondeMu es la masa molar. El valor CODATA2006 para el volumen molar del silicio es 12.058 8349(11) cm3/mol, con una incertidumbre estándar relativa de 9.1 . 10–8.[15]
A partir de los valores CODATA2006 recomendados, la relativa incertidumbre en la determinación de la constante de Avogadro por el método de la densidad del cristal por rayos X es de 1,2 . 10-7, cerca de dos veces y media mayor que la del método de la masa del electrón.
Véase también
Referencias y notas
- ↑ a b c Mohr, Peter J.; Taylor, Barry N.; Newell, David B. (2008). «CODATA Recommended Values of the Fundamental Physical Constants: 2006». Reviews of Modern Physics 80: pp. 633–730. doi:. http://physics.nist.gov/cuu/Constants/codata.pdf. Enlace directo.
- ↑ «Glossary of Terms in Quantities and Units in Clinical Chemistry (IUPAC-IFCC Recommendations 1996)» (PDF). Pure Appl. Chem. 68: pp. 957 - 1000. 1996. doi:. http://www.iupac.org/publications/pac/1996/pdf/6804x0957.pdf.
- ↑ «Atomic Weight: The Name, Its History, Definition and Units» (PDF). Pure Appl. Chem. 64: pp. 1535 – 43. 1992. doi:. http://www.iupac.org/publications/pac/1992/pdf/6410x1535.pdf.
- ↑ «Essai d'une maniere de determiner les masses relatives des molecules elementaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons». Journal de Physique 73: pp. 58–76. 1811. English translation.
- ↑ a b «Mouvement brownien et réalité moléculaire». Annales de Chimie et de Physique, 8e Série 18: pp. 1–114. 1909. Extract in English, translation by Frederick Soddy.
- ↑ Oseen, C.W. (December 10, 1926). Presentation Speech for the 1926 Nobel Prize in Physics.
- ↑ «Zur Grösse der Luftmoleküle». Sitzungsberichte der kaiserlichen Akademie der Wissenschaften Wien 52: pp. 395–413. 1865. English translation.
- ↑ «Loschmidt's Number». Science Progress 27: pp. 634–49. http://gemini.tntech.edu/~tfurtsch/scihist/loschmid.html.
- ↑ Véase, por ejemplo, Chemistry and Chemical Reactivity (7th edición). Brooks/Cole. 2008. ISBN 0495387037. http://cengagesites.com/academic/kotz.cfm?site=2719&sección=home.
- ↑ Resolution 3, 14th General Conference of Weights and Measures (CGPM), 1971.
- ↑ a b «'Atomic Weight'—The Name, Its History, Definition, and Units». Pure Appl. Chem. 64: pp. 1535–43. 1992. doi:. http://www.iupac.org/publications/pac/1992/pdf/6410x1535.pdf.
- ↑ Este relato se basa en la revisión (review) Plantilla:CODATA1998
- ↑ a b Plantilla:CODATA2002
- ↑ Mineralogy Database (2000-2005). «Unit Cell Formula». Consultado el 09-12-2007.
- ↑ Mohr, Peter J.; Taylor, Barry N.; Newell, David B. (2008). «CODATA Recommended Values of the Fundamental Physical Constants: 2006». Reviews of Modern Physics 80: pp. 633–730. doi:. http://physics.nist.gov/cuu/Constants/codata.pdf. Enlace directo.
- Este artículo fue creado a partir de la traducción del artículo Avogadro constant de la Wikipedia en inglés, bajo licencia Creative Commons Atribución Compartir Igual 3.0 y GFDL.
Enlaces externos
- 1996 definition of the Avogadro constant from the IUPAC Compendium of Chemical Terminology ("Gold Book")
- Some Notes on Avogadro's Number, 6.022×1023 (historical notes)
- An Exact Value for Avogadro's Number -- American Scientist
- Avogadro and molar Planck constants for the redefinition of the kilogram
Categorías:- Cantidad de sustancia
- Constantes físicas
Wikimedia foundation. 2010.










