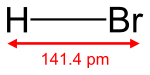
- Ácido bromhídrico
-
Ácido bromhídrico
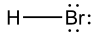
Nombre (IUPAC) sistemático Bromuro de hidrógeno General Fórmula semidesarrollada HBraq Fórmula molecular n/d Identificadores Número CAS 10035-10-6 Número RTECS MW3850000 Propiedades físicas Estado de agregación líquido Apariencia líquido acuoso transparente y amarillento. Masa molar 80,91 g/mol Punto de fusión 186 K (-87 °C) Punto de ebullición 206 K (-67 °C) Propiedades químicas Acidez (pKa) -9,0 Solubilidad en agua 100 g/ 100 ml. Termoquímica ΔfH0gas ? kJ/mol ΔfH0líquido ? kJ/mol ΔfH0sólido ? kJ/mol S0gas, 1 bar ? J·mol-1·K-1 S0líquido, 1 bar ? J·mol-1·K-1 S0sólido ? J·mol-1·K-1 Peligrosidad NFPA 704 Frases R 35,37 Frases S 1/2,7/9,26,45 Número RTECS MW3850000 Riesgos Inhalación produce corrosión, sensación de quemazón, tos, dolor de garganta. Edema pulmonar. Piel produce enrojecimiento, quemaduras cutáneas, dolor, corrosión, congelación grave. Ojos produce corrosión, enrojecimiento, dolor, quemaduras profundas y graves. LD50 76 mg/g Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl ácido bromhídrico o bromuro de hidrógeno, en disolución acuosa es un ácido fuerte, reacciona violentamente con bases y es corrosivo: altamente irritante para los ojos y para la piel. Es la solución acuosa del gas bromuro de hidrógeno.[1] Tiene un Ka igual a -9, lo que lo hace un ácido más fuerte que el ácido clorhídrico y menos fuerte que el yoduro de hidrógeno. Es uno de los ácidos minerales más fuertes conocidos, reacciona violentamente con oxidantes fuertes—como nitratos o cloratos— y muchos compuestos orgánicos, originando peligro de incendio y explosión. Ataca a muchos metales formando gas inflamable de hidrógeno.[2]
En temperatura ambiente, este tiene forma de gas; es volátil, fumante al aire y más denso que este, es no inflamable y tiene un olor picante muy parecido al del ácido clorhídrico. Su densidad es 2,8 g/cm³ respecto al aire, y por presión y enfriamiento se liquida a -73º C formando un líquido incoloro, que puede solidificarse a -120º C en una masa cristalina. El peso de un litro de bromhídrico a la presión normal y a 0º C de temperatura es de 3,6167 gramos. Al igual que el ácido clorhídrico, el ácido bromhídrico es muy soluble en el agua; reaccionando de forma violenta y liberando gas inflamable así como gases tóxicos; además, da un líquido de propiedades ácidas enérgicas que contiene los iones Br- y H+; un volumen de agua a 10º C disuelve unos 600 volúmenes de bromhídrico, y la disolución saturada a 0 °C tiene un peso específico de 1,78 y contiene 82% de HBr.[3]
Usos
El ácido bromhídrico se utiliza para elaborar productos químicos y farmacéuticos, principalmente para la producción de bromuros inorgánicos, especialmente el bromuro de zinc, calcio y sodio, también se lo emplea como solvente y en medicación veterinaria. Es un reactivo útil para la regeneración de compuestos organobromados. Ciertos éteres se rompen con ácido bromhídrico. También funciona como catalizador de reacciones de alquilación y de la extracción de cierto minerales. A partir de ácido bromhídrico se crean importantes compuestos orgánicos útiles para la industria, como lo son: bromuro de alilo, fenol y ácido bromoacético.[4]
Referencias
- ↑ alibaba.com
- ↑ ecosur.net
- ↑ enciclonet.com
- ↑ Michael J. Dagani, Henry J. Barda, Theodore J. Benya, David C. Sanders "Bromine Compounds" in Ullmann's Encyclopedia of Industrial Chemistry" Wiley-VCH, Weinheim, 2000.
Véase también
- Sustancias químicas relacionadas
- Cloruro de hidrógeno (HCl), el gas puro, del cual el ácido clorhídrico es su solución.
- Cloruro, sales inorgánicas de ácido clorhídrico.
- Ácido clórico, y su sal clorato.
- Ácido cloroso, y su sal clorito.
- Ácido hipocloroso, y su sal hipoclorito.
- Ácido perclórico, y su sal perclorato.
- ácido clorhídrico
- Bromuros
- Haluro de hidrógeno
- Haluros
- Hidrácidos-Nomenclatura
- Temas relacionados
Categoría:- Hidrácidos
Wikimedia foundation. 2010.