- Enlace por puente de hidrógeno
-
Enlace por puente de hidrógeno
 Ejemplo de enlace de hidrógeno intermolecular en un complejo dimérico autoensamblado molecular reportado por Meijer y colaboradores.[1]
Ejemplo de enlace de hidrógeno intermolecular en un complejo dimérico autoensamblado molecular reportado por Meijer y colaboradores.[1]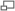
Un enlace de hidrógeno es la fuerza atractiva entre un átomo electronegativo y un átomo de hidrógeno unido covalentemente a otro átomo electronegativo. Resulta de la formación de una fuerza dipolo-dipolo con un átomo de hidrógeno unido a un átomo de nitrógeno, oxígeno o flúor (de ahí el nombre de "enlace de hidrógeno", que no debe confundirse con un enlace covalente a átomos de hidrógeno). La energía de un enlace de hidrógeno (típicamente de 5 a 30 kJ/mol) es comparable a la de los enlaces covalentes débiles (155 kJ/mol), y un enlace covalente típico es sólo 20 veces más fuerte que un enlace de hidrógeno intermolecular. Estos enlaces pueden ocurrir entre moléculas (intermolecularidad), o entre diferentes partes de una misma molécula (intramolecularidad).[2] El enlace de hidrógeno es una fuerza de van der Waals dipolo-dipolo fija muy fuerte, pero más débil que el enlace covalente o el enlace iónico. El enlace de hidrógeno está en algún lugar intermedio entre un enlace covalente y una simple atracción electrostática intermolecular. Este tipo de enlace ocurre tanto en moléculas inorgánicas tales como el agua, y en moléculas orgánicas como el ADN.
El enlace de hidrógeno intermolecular es responsable del punto de ebullición alto del agua (100°C). Esto es debido al fuerte enlace de hidrógeno, en contraste a los otros hidruros de calcógenos. El enlace de hidrógeno intramolecular es responsable parcialmente de la estructura secundaria, estructura terciaria y estructura cuaternaria de las proteínas y ácidos nucleicos.
Enlace
Un átomo de hidrógeno unido a un átomo relativamente electronegativo es un átomo donante del enlace de hidrógeno.[3] Este átomo electronegativo suele ser flúor, oxígeno o nitrógeno. Un átomo electronegativo tal como el flúor, oxígeno o nitrógeno es un aceptor de enlace de hidrógeno, sin importar si está enlazado covalentemente o no a un átomo de hidrógeno. Un ejemplo de un donante de enlace de hidrógeno es el etanol, que tiene un átomo de hidrógeno enlazado covalentemente al oxígeno; un ejemplo de aceptor de enlace de hidrógeno que no tiene un átomo de hidrógeno enlazado covalentemente a él es el átomo de oxígeno en el éter dietílico.
 Los ácidos carboxílicos suelen formar dímeros en la fase de vapor
Los ácidos carboxílicos suelen formar dímeros en la fase de vapor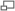
El carbono también puede participar en enlaces de hidrógeno, especialmente cuando el átomo de carbono está enlazado a algunos átomos electronegativos, como en el caso de cloroformo, CHCl3. El átomo electronegativo atrae la nube electrónica alrededor del núcleo de hidrógeno y, al decentralizar la nube, deja al átomo con una carga positiva parcial. Debido al pequeño tamaño del hidrógeno en comparación a otros átomos y moléculas, la carga resultante, aunque sólo parcial, no representa una gran densidad de carga. Un enlace de hidrógeno resulta cuando esta densidad de carga positiva fuerte atrae a un par libre de electrones de otro heteroátomo, que se convierte en el aceptor de enlace de hidrógeno.
El enlace de hidrógeno suele ser descrito como una interacción electrostática dipolo-dipolo. Sin embargo, también tiene algunas características del enlace covalente: es direccional, fuerte, produce distancias interatómicas menores que la suma de los radios de van der Waals, y usualmente involucra un número limitado de compañeros de interacción, que puede ser interpretado como un tipo de valencia. Estas características covalentes son más significativas cuando los aceptores se unen a átomos de hidrógeno de donantes más electronegativos.
La naturaleza parcialmente covalente de un enlace de hidrógeno da origen a las preguntas: "¿A qué molécula pertenece el núcleo de hidrógeno?" y "¿Cuál debería ser etiquetado como 'donante' y cuál como 'aceptor'?" Generalmente, es fácil determinar esto basándose simplemente en las distancias interatómicas del sistema X—H...Y: típicamente, la distancia X—H es ~1.1 Å, mientras que la distancia H...Y es ~ 1.6 a 2.0 Å. Los líquidos que muestran enlace de hidrógeno se llaman líquidos asociativos.
Los enlaces de hidrógeno pueden variar en fuerza, desde muy débiles (1-2 kJ mol−1) a extremadamente fuertes (>155 kJ mol−1), como en el ion dinámica molecular como se detalla en la referencia, y debería ser comparada con 7.9 kJ/mol para agua en bruto, obtenida también usando la misma dinámica molecular.)
La longitud de los enlaces de hidrógeno depende de la fuerza del enlace, temperatura, y presión. La fuerza del enlace misma es dependiente de la temperatura, presión, ángulo de enlace y ambiente (generalmente caracterizado por la constante dieléctrica local). La longitud típica de un enlace de hidrógeno en agua es 1.97 Å (197 pm). El ángulo de enlace ideal depende de la naturaleza del donante del enlace de hidrógeno. Los resultados experimentales del donante fluoruro de hidrógeno con diversos aceptores muestran los siguientes ángulos:[6]
Aceptor···Donante Simetría TREPEV Ángulo (°) HCN···HF lineal 180 H2CO ··· HF trigonal plana 110 H2O ··· HF piramidal 46 H2S ··· HF piramidal 89 SO2 ··· HF trigonal plana 145 Historia
En su libro The Nature of the Chemical Bond (en español: La Naturaleza del Enlace Químico), Linus Pauling concede los créditos a T.S. Moore y T.F. Winmill de la primera mención del enlace de hidrógeno, en 1912 (J. Chem. Soc. 101, 1635). Moore y Winmill usaron el enlace de hidrógeno para justificar el hecho que el hidróxido de trimetilamonio es una base más débil que el hidróxido de tetrametilamonio. La descripción del enlace de hidrógeno en su forma más conocida, en el agua, vino algunos años después, en 1920, por Latimer y Rodebush (JACS, 42, 1419).
Enlaces de hidrógeno en el agua
 Captura de una simulación de agua líquida. Las líneas entrecortadas de la molécula en el centro del cuadro representan enlaces de hidrógeno.
Captura de una simulación de agua líquida. Las líneas entrecortadas de la molécula en el centro del cuadro representan enlaces de hidrógeno.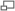
El ejemplo de enlace de hidrógeno más ubicuo, y quizás el más simple, se encuentra entre las moléculas de agua. En una molécula discreta de agua, el agua contiene dos átomos de hidrógeno y un átomo de oxígeno. Dos moléculas de agua pueden formar un enlace de hidrógeno entre ellas; en el caso más simple, cuando sólo dos moléculas están presentes, se llama dímero de agua y se usa frecuentemente como un sistema modelo. Cuando más moléculas están presentes, como en el caso del agua líquida, más enlaces son posibles, debido a que el oxígeno de una molécula de agua tiene dos pares libres de electrones, cada uno de los cuales puede formar un enlace de hidrógeno con átomos de hidrógeno de otras dos moléculas de agua. Esto puede repetirse, de tal forma que cada molécula de agua está unida mediante enlaces de hidrógeno a hasta cuatro otras moléculas de agua, como se muestra en la figura (dos a través de sus pares libres, y dos a través de sus átomos de hidrógeno).
El elevado punto de ebullición del agua se debe al alto número de enlaces de hidrógeno que cada molécula tiene, en relación a su baja masa molecular, y a la gran fuerza de estos enlaces de hidrógeno. En realidad, el agua tiene puntos de ebullición, fusión y viscosidad muy altos, comparados con otras sustancias no unidas entre sí por enlaces de hidrógeno. La razón para estos atributos en la inhabilidad, o dificultad, para romper estos enlaces. El agua es única porque sus átomos de oxígeno tiene dos pares libres y dos átomos de hidrógeno, significando que el número total de enlaces de una molécula de agua es cuatro. Por ejemplo, el fluoruro de hidrógeno -que tiene tres pares libres en el átomo de flúor, pero sólo un átomo de hidrógeno- puede tener un total de sólo dos; el amoníaco tiene el problema opuesto: tres átomos de hidrógeno, pero sólo un par libre.
- H-F...H-F...H-F
El número exacto de enlaces de hidrógeno en los que una molécula en el agua líquida participa fluctúa con el tiempo, y depende de la temperatura. A partir de simulaciones de agua líquida TIP4P a 25°C, se estima que cada molécula de agua participa en un promedio de 3,59 enlaces de hidrógeno. A 100°C, este número disminuye a 3,24, debido al incremento en el movimiento molecular y consecuente densidad disminuida, mientras que a 0°C, el número promedio de enlaces de hidrógeno se incrementa a 3,69.[7] Un estudio más reciente encontró un número mucho menor de enlaces de hidrógeno: 2,357 a 25°C[8] Las diferencias pueden deberse al uso de un método diferente para definir y contar enlaces de hidrógeno.
Donde las fuerzas de enlace son más equivalentes, se podría encontrar los átomos de dos moléculas de agua partidas en dos iones poliatómicos de carga opuesta, específicamente hidróxido (OH−) e hidronio (H3O+). (Los iones hidronio también son conocidos como iones 'hidroxonio').
- H-O− H3O+
Sin embargo, en agua pura bajo condiciones normales de presión y temperatura, esta última formulación es aplicable sólo raramente; en promedio aproximadamente una en cada 5,5 × 108 moléculas cede un protón a otra molécula de agua, en concordancia con la constante de disociación para el agua bajo tales condiciones. Es una parte crucial de la unicidad del agua.
Enlaces de hidrógeno bifurcados y sobrecoordinados en el agua
Puede darse que un solo átomo de hidrógeno participe en dos enlaces de hidrógeno, en vez de en uno. Este tipo de enlace es denominado "bifurcardo". Se ha sugerido que el enlace de hidrógeno bifurcado es un paso esencial en la reorientación del agua;.[9]
Los aceptores de enlaces de hidrógeno (que terminan en los pares libres del átomo de oxígeno) son más propensos a formar la bifurcación (en efecto, se le denomina oxígeno sobrecoordinado) que los donantes.[10]
Enlaces de hidrógeno en ADN y proteínas
El enlace de hidrógeno también juega un rol importante en la determinación de las estructuras tridimensionales adoptadas por las proteínas y ácidos nucleicos. En estas macromoléculas, el enlace de hidrógeno entre partes de la misma molécula ocasiona que se doble en una forma específica, que ayuda a determinar el rol fisiológico o bioquímico de la molécula. Por ejemplo, la estructura de doble hélice del ADN se debe primordialmente a los enlaces de hidrógeno entre los pares de bases, que unen una cadena complementaria a la otra y permiten la replicación.
En las proteínas, los enlaces de hidrógeno se forman entre átomos de oxígeno esqueletales y átomos de hidrógeno amida. Cuando el espaciamiento de los residuos de aminoácido que participan en un enlace de hidrógeno es regular entre las posiciones i e i + 4, se forma una hélice alfa. Cuando el espaciamiento es menor, entre las posiciones i e i + 3, se forma una plegamiento de proteínas).
Enlace de hidrógeno simétrico
Un enlace de hidrógeno simétrico es un tipo especial de enlace de hidrógeno en el que el núcleo de hidrógeno está exactamente a mitad de camino entre dos átomos del mismo elemento. La fuerza del enlace a cada uno de estos átomos es igual. Constituye un ejemplo de un enlace de tres centros y dos electrones. Este tipo de enlace es mucho más fuerte que los enlaces de hidrógeno "normales". El orden efectivo de enlace es 0.5, así que su fuerza es comparable a un enlace covalente. Se ha visto en hielo a altas presiones, y también en la fase sólida de muchos ácidos anhidros, como el fluoruro de hidrógeno y el ácido fórmico a altas presiones. También se le ha visto en el anión bifluoruro [F-H-F]−.
Los enlaces de hidrógeno simétricos han sido observados recientemente espectroscópicamente en el ácido fórmico a presión alta (>GPa). Cada átomo de hidrógeno forma un enlace covalente parcial con dos átomos, en vez de con uno. Se ha postulado la existencia de enlaces de hidrógeno simétricos en el hielo a altas presiones (Hielo X). Se forman bajas barreras de enlace de hidrógeno cuando la distancia entre dos heteroátomos es muy pequeña.
Enlace de dihidrógeno
El enlace de hidrógeno puede ser comparado con el cercanamente relacionado enlace de dihidrógeno, que también es una interacción enlazante intermolecular que involucra a átomos de hidrógeno. Estas estructuras han sido conocidas por algún tiempo, y bien caracterizadas por cristalografía de rayos X; sin embargo, una comprensión de su relación con el enlace de hidrógeno convencional, enlace iónico y enlace covalente permanece oscura. Generalmente, el enlace de hidrógeno está caracterizado por un aceptor de protones, que es un par libre de electrones en átomos no metálicos (principalmente en el nitrógeno y oxígeno). En algunos casos, estos aceptores de protones pueden ser orbitales pi o algún complejo metálico. Sin embargo, en el enlace de dihidrógeno, un hidruro metálico sirve como aceptor de protones; formando una interacción hidrógeno-hidrógeno.
La difracción de neutrones ha mostrado que la geometría molecular de estos complejos es similar a los enlaces de hidrógeno, en el que la longitud de enlace se adapta muy bien a los sistemas complejo metálico/donante de hidrógeno.
Teoría avanzada del enlace de hidrógeno
Recientemente, la naturaleza del enlace fue elucidada. Un artículo ampliamente publicado[11] probó, a partir de interpretaciones de anisotropía en el perfil de Compton del hielo ordinario, que el enlace de hidrógeno es parcialmente covalente. Parte de la información de resonancia magnética nuclear sobre los enlaces de hidrógeno en las proteínas también indica que hay enlace covalente.
Más generalmente, el enlace de hidrógeno puede ser visto como un campo escalar electrostático dependiente de la métrica, entre dos o más enlaces intermoleculares. Esto es ligeramente diferente de los estados ligados intramoleculares de, por ejemplo, el enlace covalente o el enlace iónico; sin embargo, el enlace de hidrógeno sigue siendo un fenómeno de estado ligado, puesto que la energia de interacción tiene una suma neta negativa. La teoría inicial del enlace de hidrógeno propuesta por Linus Pauling sugería que los enlaces de hidrógeno tenían una naturaleza parcialmente covalente. Esto permaneció como una conclusión controversial hasta finales de la década de 1990, cuando mediante técnicas de RMN empleadas por F. Cordier et al. para transferir información entre núcleos enlazados por hidrógeno, una característica que sólo sería posible si el enlace de hidrógeno contuviera algún carácter covalente.
Fenómenos debidos al enlace de hidrógeno
- Punto de ebullición dramáticamente alto del NH3, H2O y HF, en comparación a los análogos más pesados PH3, H2S, y HCl
- Viscosidad del ácido fosfórico anhidro y del glicerol.
- Formación de dímeros en ácidos carboxílicos y de hexámeros en el fluoruro de hidrógeno, que ocurre incluso en la fase gaseosa, resultando en grandes desviaciones de la ley de los gases ideales.
- La alta solubilidad en agua de muchos compuestos como el amoníaco es explicada por el enlace de hidrógeno con las moléculas de agua.
- La azeotropía negativa de mezclas de HF y agua.
- La delicuescencia del NaOH es causada, en parte, por la reacción de OH- con la humedad para formar especies H3O2- enlazadas por hidrógeno. Un proceso análogo sucede entre NaF y HF.
- El hecho de que el hielo es menos denso que el agua líquida se debe a una estructura cristalina estabilizada por enlaces de hidrógeno.
- La presencia de enlaces de hidrógeno puede causar una anomalía en la sucesión normal de los estados de agregación para ciertas mezclas de compuestos químicos, con el incremento o disminución de temperatura. Estos compuestos pueden ser líquidos hasta una cierta temperatura, luego son sólidos incluso con el incremento de temperatura, y finalmente líquidos cuando la temperatura se eleva sobre el "intervalo anómalo"[12]
- La goma inteligente utiliza enlaces de hidrógeno como su única forma de enlace, así que puede "sanarse" cuando se pincha, debido a que puede aparecer nuevos enlaces de hidrógeno entre las dos superficies del mismo polímero
Referencias
- ↑ Felix H. Beijer, Huub Kooijman, Anthony L. Spek, Rint P. Sijbesma, E. W. Meijer (1998). «Self-Complementarity Achieved through Quadruple Hydrogen Bonding» Angew. Chem. Int. Ed.. Vol. 37. pp. 75–78. DOI <75::AID-ANIE75>3.0.CO;2-R 10.1002/(SICI)1521-3773(19980202)37:1/2<75::AID-ANIE75>3.0.CO;2-R.
- ↑ International Union of Pure and Applied Chemistry. "hydrogen bond". Compendium of Chemical Terminology Internet edition.(en inglés)
- ↑ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6.
- ↑ Emsley, J. (1980). «Very Strong Hydrogen Bonds» Chemical Society Reviews. Vol. 9. pp. 91–124. DOI 10.1039/cs9800900091.
- ↑ Omer Markovitch and Noam Agmon (2007). «Structure and energetics of the hydronium hydration shells» J. Phys. Chem. A. Vol. 111. n.º 12. pp. 2253–2256. DOI 10.1021/jp068960g.
- ↑ A. C. Legon;D. J. Millen. Chem. Soc. Rev. 1987, 16,467-498.[1]
- ↑ W. L. Jorgensen and J. D. Madura (1985). «Temperature and size dependence for Monte Carlo simulations of TIP4P water» Mol. Phys.. Vol. 56. n.º 6. pp. 1381. DOI 10.1080/00268978500103111.
- ↑ Jan Zielkiewicz (2005). «Structural properties of water: Comparison of the SPC, SPCE, TIP4P, and TIP5P models of water» J. Chem. Phys.. Vol. 123. pp. 104501. DOI 10.1063/1.2018637..
- ↑ Damien Laage and James T. Hynes (2006). «A Molecular Jump Mechanism for Water Reorientation» Science. Vol. 311. pp. 832. DOI 10.1126/science.1122154. PMID 16439623.
- ↑ Omer Markovitch & Noam Agmon (2008). «The Distribution of Acceptor and Donor Hydrogen-Bonds in Bulk Liquid Water» Molecular Physics. Vol. 106. pp. 485. DOI 10.1080/00268970701877921.
- ↑ E.D. Isaacs, et al., Physical Review Letters vol. 82, pp 600-603 (1999)
- ↑ Law-breaking liquid defies the rules at physicsworld.com
- George A. Jeffrey. An Introduction to Hydrogen Bonding (Topics in Physical Chemistry). Oxford University Press, USA (March 13, 1997). ISBN 0-19-509549-9
- Robert H. Crabtree, Per E. M. Siegbahn, Odile Eisenstein, Arnold L. Rheingold, and Thomas F. Koetzle (1996). «A New Intermolecular Interaction: Unconventional Hydrogen Bonds with Element-Hydride Bonds as Proton Acceptor» Acc. Chem. Res.. Vol. 29. n.º 7. pp. 348–354. DOI 10.1021/ar950150s.
- Alexander F. Goncharov, M. Riad Manaa, Joseph M. Zaug, Richard H. Gee, Laurence E. Fried, and Wren B. Montgomery (2005). «Polymerization of Formic Acid under High Pressure» Phys. Rev. Lett.. Vol. 94. n.º 6. pp. 065505. DOI 10.1103/PhysRevLett.94.065505.
- F. Cordier, M. Rogowski, S. Grzesiek and A. Bax (1999). «Observation of through-hydrogen-bond (2h)J(HC') in a perdeuterated protein» J Magn Reson.. Vol. 140. pp. 510–2. DOI 10.1006/jmre.1999.1899.
- R. Parthasarathi, V. Subramanian, N. Sathyamurthy (2006). «Hydrogen Bonding Without Borders: An Atoms-In-Molecules Perspective» J. Phys. Chem. (A). Vol. 110. pp. 3349–3351.
- Z. Liu, G. Wang, Z. Li, R. Wang (2008). «Geometrical Preferences of the Hydrogen Bonds on Protein−Ligand Binding Interface Derived from Statistical Surveys and Quantum Mechanics Calculations» J. Chem. Theory Comput. (A). Vol. 4. n.º 11. pp. 1959–1973. DOI 10.1021/ct800267x.
Enlaces externos
- The Bubble Wall (Presentación de diapositivas del National High Magnetic Field Laboratory explicando la cohesión, tensión superficial y enlaces de hidrógeno, en inglés)
Categoría: Enlace químico
Wikimedia foundation. 2010.



