- Lck
-
Lck (o proteína tirosina quinasa específica de leucocitos) es una proteína que se encuentra dentro de células especializadas del sistema inmunitario llamadas linfocitos. Lck es una tirosina quinasa no específica (EC 2.7.10.1), que fosforila residuos de tirosina de ciertas proteínas involucradas en las vías de señalización intracelular de estos linfocitos. Es un miembro de la familia Src de las tirosincinasas.
Contenido
Lck y señalización de células T
Lck se encuentra más comúnmente en células T. Se asocia con las colas citoplasmáticas de los correceptores CD4 y CD8 en células T cooperadoras y células T citotóxicas, respectivamente, para ayudar a la señalización desde el complejo receptor de células T (TCR). Cuando el TCR es activado por la presentación del antígeno específico mediante el MHC, Lck actúa para fosforilar las cadenas intracelulares del CD3 y las cadenas ζ del complejo TCR, permitiendo la unión de otra tirosina quinasa citoplasmática llamada ZAP-70. Lck entonces fosforila y activa ZAP-70, que a su vez fosforila otra molécula en la cascada de señalización llamada LAT (abreviatura de Linker of Activated T cells), una proteína transmembranal que sirve como un sitio de anclaje para varias otras proteínas, siendo las más importantes Shc-Grb2-SOS, PI3K y fosfolipasa C (PLC).
La cascada de fosforilación de tirosina iniciada por la Lck culmina en la movilización intracelular de ion calcio (Ca2+) y la activación de importantes cascadas de señalización dentro de los linfocitos. Estos incluyen la vía Ras-MEK-ERK, que se basa en activar ciertos factores de transcripción como NFAT, NFκB y AP-1. Estos factores de transcripción regulan la producción de una plétora de productos de los genes, más notablemente citoquinas como la interleucina-2 que fomenta la proliferación y diferenciación a largo plazo de los linfocitos activados.
La función de la Lck ha sido estudiada usando varios métodos bioquímicos, incluyendo la genética inversa (ratones Knockout), las células Jurkat deficientes en Lck (JCaM1.6) o la mediante RNA de interferencia.
Estructura de la Lck
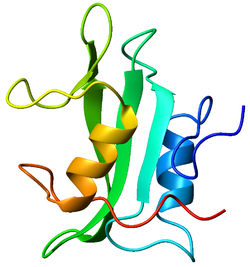
La Lck es una proteína de 56 kDa. La cola N-terminal de la Lck es miristoilada y palmitoilada lo cual ancla la proteína a la membrana plasmática de la célula. La proteína contiene además un dominio SH3, un dominio SH2 y en la parte C-terminal del dominio tirosincinasa. Los dos principales sitios de fosforilación en las Lck son las tirosinas 394 y 505. El primero es un sitio de autofosforilación y está vinculado a la activación de la proteína. El segundo es fosforilizado por la Csk que inhibe la Lck porque la proteína se pliega y se une a su propio dominio SH2. La Lck sirve así como un ejemplo instructivo de que la fosforilación de proteínas puede tener como consecuencia tanto la activación como la inhibición.
Sustratos de la Lck
La tirosina Lck fosforiliza varias proteínas donde las más importantes son: el receptor CD3, la ZAP-70, la SLP-76, el receptor IL-2, la proteína quinasa C, la ITK, la PLC, la SHC, la RasGAP, la Cbl, la Vav1 y la PI3K.
Inhibición de la Lck
En células T en reposo, la Lck es esencialmente inhibida por la fosforilación Csk en la tirosina 505. La Lck también es inhibida por la desfosforilación SHP-1 en la tirosina 394. La Lck también puede ser inhibida por la Cbl ubiquitina ligasa, que es parte de la vía mediante ubiquitina.[1]
Referencias
- ↑ Rao et al. Negative regulation of Lck by Cbl ubiquitin ligase. PNAS, 2002,vol. 99, 3794-3799.
Lecturas adicionales
- Sasaoka T, Kobayashi M (2000). «The functional significance of Shc in insulin signaling as a substrate of the insulin receptor.». Endocr. J. 47 (4): pp. 373-81. PMID 11075717.
- Goldmann WH (2003). «p56(lck) Controls phosphorylation of filamin (ABP-280) and regulates focal adhesion kinase (pp125(FAK)).». Cell Biol. Int. 26 (6): pp. 567-71. PMID 12171035.
- Mustelin T, Taskén K (2003). «Positive and negative regulation of T-cell activation through kinases and phosphatases.». Biochem. J. 371 (Pt 1): pp. 15-27. doi:. PMID 12485116.
- Zamoyska R, Basson A, Filby A, et al. (2003). «The influence of the src-family kinases, Lck and Fyn, on T cell differentiation, survival and activation.». Immunol. Rev. 191: pp. 107-18. PMID 12614355.
- Summy JM, Gallick GE (2004). «Src family kinases in tumor progression and metastasis.». Cancer Metastasis Rev. 22 (4): pp. 337-58. PMID 12884910.
- Leavitt SA, SchOn A, Klein JC, et al. (2004). «Interactions of HIV-1 proteins gp120 and Nef with cellular partners define a novel allosteric paradigm.». Curr. Protein Pept. Sci. 5 (1): pp. 1-8. PMID 14965316.
- Tolstrup M, Ostergaard L, Laursen AL, et al. (2004). «HIV/SIV escape from immune surveillance: focus on Nef.». Curr. HIV Res. 2 (2): pp. 141-51. PMID 15078178.
- Palacios EH, Weiss A (2004). «Function of the Src-family kinases, Lck and Fyn, in T-cell development and activation.». Oncogene 23 (48): pp. 7990-8000. doi:. PMID 15489916.
- Joseph AM, Kumar M, Mitra D (2005). «Nef: "necessary and enforcing factor" in HIV infection.». Curr. HIV Res. 3 (1): pp. 87-94. PMID 15638726.
- Levinson AD, Oppermann H, Levintow L, et al. (1979). «Evidence that the transforming gene of avian sarcoma virus encodes a protein kinase associated with a phosphoprotein.». Cell 15 (2): pp. 561-72. PMID 214242.
- Thomas PM, Samelson LE (1992). «The glycophosphatidylinositol-anchored Thy-1 molecule interacts with the p60fyn protein tyrosine kinase in T cells.». J. Biol. Chem. 267 (17): pp. 12317-22. PMID 1351058.
- Shenoy-Scaria AM, Kwong J, Fujita T, et al. (1992). «Signal transduction through decay-accelerating factor. Interaction of glycosyl-phosphatidylinositol anchor and protein tyrosine kinases p56lck and p59fyn 1.». J. Immunol. 149 (11): pp. 3535-41. PMID 1385527.
- Brown R, Meldrum C, Cousins S (1993). «Are sense-antisense peptide interactions between HIV-1 (gp120), CD4, and the proto oncogene product p56lck important?». Med. Hypotheses 38 (4): pp. 322-4. PMID 1491632.
- Weber JR, Bell GM, Han MY, et al. (1992). «Association of the tyrosine kinase LCK with phospholipase C-gamma 1 after stimulation of the T cell antigen receptor.». J. Exp. Med. 176 (2): pp. 373-9. PMID 1500851.
- Cefai D, Ferrer M, Serpente N, et al. (1992). «Internalization of HIV glycoprotein gp120 is associated with down-modulation of membrane CD4 and p56lck together with impairment of T cell activation.». J. Immunol. 149 (1): pp. 285-94. PMID 1535086.
- Soula M, Fagard R, Fischer S (1992). «Interaction of human immunodeficiency virus glycoprotein 160 with CD4 in Jurkat cells increases p56lck autophosphorylation and kinase activity.». Int. Immunol. 4 (2): pp. 295-9. PMID 1535787.
- Crise B, Rose JK (1992). «Human immunodeficiency virus type 1 glycoprotein precursor retains a CD4-p56lck complex in the endoplasmic reticulum.». J. Virol. 66 (4): pp. 2296-301. PMID 1548763.
- Molina TJ, Kishihara K, Siderovski DP, et al. (1992). «Profound block in thymocyte development in mice lacking p56lck.». Nature 357 (6374): pp. 161-4. doi:. PMID 1579166.
- Yoshida H, Koga Y, Moroi Y, et al. (1992). «The effect of p56lck, a lymphocyte specific protein tyrosine kinase, on the syncytium formation induced by human immunodeficiency virus envelope glycoprotein.». Int. Immunol. 4 (2): pp. 233-42. PMID 1622897.
- Torigoe T, O'Connor R, Santoli D, Reed JC (1992). «Interleukin-3 regulates the activity of the LYN protein-tyrosine kinase in myeloid-committed leukemic cell lines.». Blood 80 (3): pp. 617-24. PMID 1638019.
Véase también
- Tirosincinasa
- Célula T
Enlaces externos
Categorías:- Transducción de señales
- Tirosina proteína kinasas
- Genes del cromosoma 1
- Linfocitos
- Siglas
Wikimedia foundation. 2010.