- Par solitario
-
Par solitario
Un par solitario es un par de electrones de valencia que no se encuentra formando un enlace, ni compartido con otros átomos. Cuando un átomo se agrupa con otros para formar una molécula, sus electrones más externos -también conocidos como electrones de capa de valencia- dejan de pertenecer únicamente al átomo del que provienen, pasando a pertenecer a la molécula formada. Los orbitales atómicos de valencia dejan de existir como tales y pasan a formar orbitales moleculares con características diferentes a las originales. Como los pares solitarios se encuentran en la capa mas externa de los átomos, cuando estos átomos forman moléculas pasan a formar parte del conjunto de electrones de valencia de la molécula. De esto se deduce que los pares solitarios son, de hecho, un subconjunto de los electrones de valencia de la molécula a la que pertenecen.
Los pares solitarios pueden ser identificados sin mucha dificultad al hacer un análisis de los niveles electrónicos mas externos de un átomo: un par solitario es un par de electrones apareados, lo que los diferencia de los electrones solitarios (desapareados) que suelen ocupar orbitales atómicos que no se encuentran completos.
Un par de electrones, por lo tanto, es considerado un par solitario; si se encuentra formado por un par de electrones apareados, pero que no están siendo utilizados para formar un enlace. Integrando este concepto con los anteriores se puede concluir que el número de electrones de valencia de una molécula es igual al numero de electrones enlazantes que posee, mas el número de electrones que se encuentran formando pares solitarios.
Los átomos que al formar moléculas presentan con facilidad pares solitarios se encuentran en el extremo derecho de la tabla periódica, y en especial en la esquina superior, ya que, bajando por las columnas, la presencia de orbitales d y f en los átomos mas complejos altera (a veces de manera aparentemente imprevisible) sus distribuciones electrónicas.
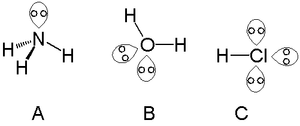
Así es posible encontrar un único par solitario en las moléculas formadas por átomos del grupo del nitrógeno -un buen ejempro de esto es el amoníaco (A)-, es posible encontrar dos pares solitarios en moléculas formadas por átomos del grupo del oxígeno -por ejemplo en el agua (B)-; y es posible encontrar tres pares solitarios en moléculas formadas por átomos del grupo del flúor -por ejemplo en el ácido clorhídrico (C).
Contenido
Alteración de los ángulos de enlace y polaridad
El par solitario, con frecuencia, otorga un carácter polar a la molécula (o región molecular) a la cual pertenece. Esto ocurre porque el par solitario representa una gran acumulación de densidad de carga negativa en una región muy próxima a un núcleo atómico. Esta gran acumulación de densidad de carga provoca una fuerte repulsión electrostática sobre los electrones que se encuentran formando enlaces, forzando a que estos enlaces se aproximen entre sí. Como consecuencia los ángulos de enlace se reducen y se provoca una asimetría estructural en la molécula. La combinación de asimetría estructural y asimetría en la distribución de carga causa la polaridad.
Esto se puede observar con mucha claridad al comparar dos moléculas muy comunes, el dióxido de carbono y el agua. En el dióxido de carbono los cuatro electrones de valencia del carbono están siendo ocupados para formar enlaces con dos átomos de oxígeno, en este caso las únicas repusiones que existen son las que se establecen entre los electrones de enlace, por lo que sería esperable que en este caso los enlaces O=C=O se encontraran lo más separados que fuera posible entre sí. Esto de hecho ocurre ya que es posible demostrar sin mucha dificultad que la molécula de dióxido de carbono es apolar, y por sus espectros de absorción en el infrarrojo, que se trata de una molécula lineal, con unos ángulos de enlace O=C=O de 180º. En el agua, por el contrario, sólo dos de los seis electrones de valencia del oxígeno se utilizan para formar enlaces con el hidrógeno, los cuatro electrones de valencia restantes forman dos pares solitarios de electrones. Sería de esperar que estos pares solitarios modificaran el ángulo de enlace H-O-H, cosa que de hecho ocurre, es fácil demostrar que la molécula de agua es polar, y por sus espectros de absorción en el infrarrojo, es fácil deducir que no se trata de una molécula lineal. En el agua el ángulo de enlace H-O-H es de 104,5º y no 180º, la repulsión provocada por los dos pares solitarios de electrones causan la reducción del ángulo de enlace forzando a los átomos de hidrógeno a acercarse entre sí hasta el punto donde todas las fuerzas de repulsión entre electrones quedan equilibradas. Este es un claro ejemplo de como permite hacer inferencias la Teoría de Repulsion de Pares de Electrones de la Capa de Valencia (TRPECV).
Pares solitarios y nucleofilicidad
La presencia de pares solitarios en las moléculas les otorgan una serie de características bastante notables, pues estos pares de electrones no compartidos pueden ser utilizados para formar enlaces covalentes coordinados -también llamados covalente dativos- con otras moléculas. Se dice entonces que las moleculas que poseen pares solitarios pueden actuar como buenos nucleófilos. Esto es así porque gracias a su par de electrones con alta densidad de carga negativa, pueden atacar regiones con densidad de carga positiva en otras moléculas forzando la formación de nuevos enlaces.
Este tipo de reacciones se pueden hacer aún mas abarcativas considerando a las moléculas con pares solitarios como bases de Lewis capaces de reaccionar con otras moléculas (o átomos) que poseen orbitales no ocupados para formar aductos de Lewis. Bajo esta consideración podemos encuadrar a las reacciones electrofílicas, a las de ácido-base y a las de formación de complejos, dentro de las reacciones que implican pares solitarios de electrones.
Un ejemplo sencillo de la formación de este tipo de enlaces es el que ocurre en la formación del ión hidronio(H3O+). Este ión aparece cuando se disuelven ácidos en agua, y ocurre porque el átomo de oxigeno es capaz de aportar un par solitario de electrones para estabilizar al ión hidrogeno H+ liberado por el ácido, actuando a la vez como nucleófilo y como base de Lewis.
Pares solitarios inusuales
Contrariamente a lo que cabría esperar debido a su configuración electronica formal, que es de tipo ns2 (esférica y por lo tanto totalmente isotrópica), los iones divalentes de plomo y estaño presentan un par solitario estereoquímicamente activo. En el estado sólido esto provoca la coordinación distorsionada que se observa en la estructura litargírica de los óxidos PbO y SnO. La formación de estos iones atípicos ns2 de metales pesados, que se atribuyó primeramente a una hibridación intraatómica entre los orbitales s y p del metal,[1] ha demostrado recientemente tener una fuerte dependencia con los estados electrónicos del anión.[2] Esta dependencia con los estados electrónicos del anión puede explicar porque en algunos compuestos divalentes de plomo y estaño tales como el PbS y SnS no presentan evidencia estereoquímica de un par solitario y adoptan la estructura simétrica de la sal común.[3] [4] En muchos sistemas moleculares coordinados el par solitario puede causar además la distorsión de la estructura de coordinación de los ligandos en torno al ión metálico central. El efecto de par solitario tipo plomo puede ser observado en complejos supramoleculares de nitrato de plomo (II), y en un estudio computacional de 2007[5] se vinculaba al par solitario del plomo con su toxicidad. Los iones de plomo introducidos en el metabolismo humano reemplazan a los iones metálicos nativos de numerosas proteínas clave, por ejemplo al cinc en la enzima porfobilinógeno sintetasa. Esta parece ser la base molecular del envenenamiento por plomo o saturnismo. Los experimentos computacionales revelan que, a pesar de que el número de coordinación del catión central no cambia al ocurrir la sustitución dentro de proteínas coordinadas al calcio, la introducción de plomo causa una distorsión en la manera como los ligandos se organizan entre sí para acomodar al par solitario, en consecuencia la estructura de la proteína queda perturbada. Esta perturbción de par solitario se vuelve dramática para proteínas que coordinan cinc, tales como la antes mencionada porfobilinógeno sintasa; como consecuencia la proteína ya no puede unir a su sustrato natural y queda inhibida.
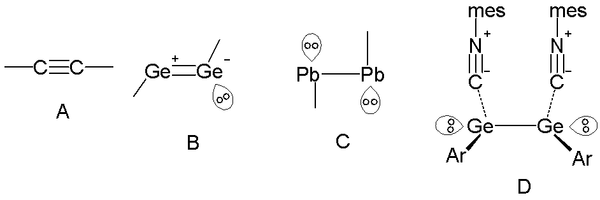
Los pares solitarios de los átomos del grupo 14 se manifiestan también en los triples enlaces. Los familiares alquinos poseen un orden de enlace de 3 con un ángulo de enlace de 180º (A), pero bajando por el grupo, los triples enlaces germanio-germanio, tienen un orden de enlace efectivo de 2 con un par no enlazante (B) y una geometría de tipo "trans" distorsionada. Y aún mas, en los compuestos de plomo el orden de enlace efectivo desciende hasta 1 con un par de electrones solitarios sobre cada átomo (C). En los compuestos de organogermanio (D), el orden de elace es también 1 acomplejando grupos de ácidos isonitrilo, en base a la interacción con los orbitales 4p vacíos del germanio.[6]
Véase también
Referencias
- ↑ Stereochemistry of Ionic Solids J.D.Dunitz and L.E.Orgel, Advan. Inorg. and Radiochem. 1960, 2, 1-60
- ↑ Electronic origins of structural distortions in post-transition metal oxides: experimental and theoretical evidence for a revision of the lone pair model D.J.Payne, R.G.Egdell, A.Walsh, G.W.Watson, J.Guo, P.-A.Glans, T.Learmonth and K.E.Smith, Phys. Rev. Lett. 2006, 96, 157403 DOI 10.1103/PhysRevLett.96.157403
- ↑ The origin of the stereochemically active Pb(II) lone pair: DFT calculations on PbO and PbS A.Walsh and G.W.Watson, J. Sol. Stat. Chem. 2005, 178, 5 DOI 10.1016/j.jssc.2005.01.030
- ↑ Influence of the Anion on Lone Pair Formation in Sn(II) Monochalcogenides: A DFT Study A.Walsh and G.W.Watson, J. Phys. Chem. B 2005, 109, 18868 DOI 10.1021/jp051822r
- ↑ Is an Electronic Shield at the Molecular Origin of Lead Poisoning? A Computational Modeling Experiment C.Gourlaouen and O.Parisel Angew. Chem. Int. Ed. 2007, 46, 553 –556 DOI 10.1002/anie.200603037
- ↑ Lewis base induced tuning of the Ge–Ge bond order in a digermyne G.H.Spikes and P.P.Power Chem. Commun., 2007, 85 - 87, DOI 10.1039/b612202g
Categoría: Química teórica
Wikimedia foundation. 2010.