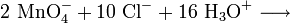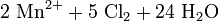- Permanganato de potasio
-
Permanganato de potasio
 Permanganato de potasio
Permanganato de potasioNombre (IUPAC) sistemático Manganato (VII) de potasio General Otros nombres Permanganto de potasio
Permanganto potásicoFórmula semidesarrollada KMnO4 Fórmula molecular n/d Identificadores Número CAS 7722-64-7 Propiedades físicas Estado de agregación Sólido Apariencia Véase imagen Densidad 27030 kg/m3; 27,03 g/cm3 Masa molar 158.03 g/mol Punto de fusión 513 K (240 °C) Punto de ebullición K (-273,15 °C) Propiedades químicas Solubilidad en agua 6.38 g/100 ml at 20 °C Peligrosidad NFPA 704 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl permanganato de potasio (KMnO4) es un compuesto químico formado por iones potasio (K+) y permanganato (MnO4−). Es un fuerte agente oxidante. Tanto sólido como en solución acuosa presenta un color violeta intenso.
Usos
Es utilizado como agente oxidante en muchas reacciones químicas en el laboratorio y la industria.
Se aprovechan tambie´n sus propiedades desinfectantes y en desodorantes. Se utiliza para tratar algunas enfermedades parasitarias de los peces, o en el tratamiento de algunas afecciones de la piel como hongos o dermatitis. Además se puede administrar como remedio de algunas intoxicaciones con venenos oxidables como el fósforo elemental o picaduras de serpientes.
Una aplicación habitual se encuenra en el tratamiento del agua potable. En África, mucha gente lo usa para remojar vegetales con el fin de neutralizar cualquier bacteria que esté presente. Puede ser usado como reactivo en la síntesis de muchos compuestos químicos. Por ejemplo, una solución diluida de permanganato puede convertir un alqueno en un diol y en condiciones drásticas bajo ruptura del enlace carbono-carbono en ácidos. Esta reacción se aprovecha en la síntesis del ácido adípico a partir de ciclohexeno.
El poder oxidante del ion permanganato se incrementa también en disolución orgánica utilizando condiciones de transferencia de fase con eter de corona para solubilizar el el potasio en este medio.
Una reacción más clásica es la oxidación de un grupo metilo unido a un anillo aromático en un grupo carboxilo. Esta reacción requiere condiciones básicas.
En química analítica, una solucion acuosa estandarizada se utiliza con frecuencia como titulante oxidante en titulaciones redox debido a su intenso color violeta.
El permanganato violeta se reduce al cation Mn+2, incoloro, en soluciones ácidas. En soluciones neutras, el permanganato sólo se reduce a MnO2, un precipitado marrón en el cual el manganeso tiene su estado de oxidación +4. En soluciones alcalinas, se reduce a su estado +6, dando K2MnO4.
Soluciones diluidas se utilizan como enjuague bucal (0,15 %), desinfectante para las manos (alrededor del 1.8 %).
Se utiliza como reactivo para determinar el número Cappa de la pulpa de madera.
En el laboratorio se emplea el K2MnO4 junto con [[ácido clorhídrico] en la síntesis de cloro elemental según la reacción:
Historicamenet el permanganato de potasio formaba parte de los polvos usados como flash en fotografía o para iniciar la reacción de termita.
También se ha descrito su uso en el camuflaje de los caballos blancos durante la segunda guerra mundial debido a la formación de MnO2 marrón.
Precauciones
El KMnO4 sólido es un oxidante muy fuerte, que mezclado con glicerina pura provocará una reacción fuertemente exotérmica. Reacciones de este tipo ocurren al mezclar KMnO4 sólido con muchos materiales orgánicos. Sus soluciones acuosas son bastante menos peligrosas, especialmente al estar diluídas. Mezclando KMnO4 sólido con ácido sulfúrico concentrado forma Mn2O7 que provoca una explosión. La mezcla del permanganato sólido con ácido clorhídrico concentrado genera el peligroso gas cloro.
El permanganato mancha la piel y la ropa (al reducirse a MnO2) y debería por lo tanto manejarse con cuidado. Las manchas en la ropa se pueden lavar con ácido acético. Las manchas en la piel desaparecen dentro de las primeras 48 horas. Sin embargo, las manchas pueden ser eliminadas con un sulfito o bisulfito de sodio.
Utilidades
El permanganato de potasio se utiliza en algunas ocasiones para realizar lavados gástricos en ciertas intoxicaciones ejemplo: fósforo blanco]ref: Uribe Granja Manuel G., Heredia de C. Elsa. Fósforo, intoxicaciónpor fósforo inorganico.. También en dermatología, por su acción fungicida.
Categorías: Toxicología | Permanganatos | Antisépticos de uso tópico | Compuestos de potasio
Wikimedia foundation. 2010.