- Ratón de laboratorio
-
Ratón de laboratorio
El ratón de laboratorio es un roedor, usualmente de la especie Mus musculus, que se utiliza para la investigación científica. Con frecuencia los ratones de laboratorio son blancos, y algunos son albinos.
Los ratones de laboratorio deben pertenecer a una cepa pura o endogámica. Los individuos de una misma cepa llevan los mismos genes, por lo cual se facilita la comparación de los efectos de los diferentes tratamientos (fármacos, entorno físico, etc.) sin que se produzca confusión debido a las diferencias genéticas. La cepa más utilizada ha sido la C57, aunque existen disponibles muchas variedades, especialmente desde el desarrollo de técnicas de manipulación de genes que han provisto una gran cantidad de cepas con modificaciones genéticas particulares.[1]
Algunas investigaciones particulares pueden requerir de una especie de ratón diferente a “Mus musculus,” por ejemplo, en 2004 unos investigadores de la Universidad de Emory utilizaron los ratones de las praderas (Microtus ochrogaster) y los ratones de los pantanos (Microtus pennsylvanicus) para estudiar un gen relacionado con el comportamiento monógamo.
Las características que han hecho del ratón de laboratorio el modelo biológico y biomédico más utilizado en las investigaciones científicas son:
- Fácil manejo
- Tamaño apropiado para la crianza y manipulación
- No requieren demasiados cuidados.
- Tienen un sistema inmune similar al de los seres humanos.
- Tienen un alto número de crías.
- Poseen un breve período de gestación (19-21 días) y rápido destete.
- Las hembras producen un gran número de óvulos, los cuales al ser fecundados son muy resistentes.
- Al ser mamíferos euterios, al igual que el hombre, tienen un genoma muy similar a los humanos.
En la actualidad se utilizan ratones que se han manipulado genéticamente. Los modelos de ratón transgénico y knock-out son particularmente útiles para estudiar problemas biológicos complejos, ya que se puede analizar la acción de un gen o una proteína en particular.
Contenido
Cepa C57BL/6
C57BLACK6, abreviada como C57BL/6 o black 6 es la cepa endogámica de ratón de laboratorio más ampliamente usada para ser manipulada genéticamente en el estudio de las enfermedades humanas. Esta cepa fue la que se utilizó para el proyecto genoma del ratón que termino en 2002.
Su pelaje es café oscuro, casi negro. Tiene un temperamento fácilmente irritable.
Contexto genético y evolutivo
Los seres humanos y los ratones de laboratorio (ambos mamíferos euterios) compartieron un último antepasado común hace 60 millones de años aproximadamente. La evolución del genoma de los mamíferos es relativamente conservadora. Si bien los humanos poseen antepasados comunes con todos los seres vivos, el hecho que los humanos y los ratones sean mamíferos euterios hace que tengan más genes en común que los que se podrían encontrar entre los humanos y animales no-euterios.
Los ratones tienen su genoma agrupado en 20 pares de cromosomas, mientras que los seres humanos tienen 23. Los genomas de los humanos y los ratones de laboratorio son muy similares, el genoma de los humanos posee 2.900 millones de pares de bases mientras que el del ratón contiene alrededor de 2.600 millones.
El mapeo genético ha puesto en evidencia que algunos genes que se encuentran en un mismo cromosoma humano están ubicados en diferentes cromosomas en los ratones. Por ejemplo, en el cromosoma 12 humano se encuentran agrupados los genes GADP, TPI, LDHB, KRAS2, INT1, GL1 y LALB, mientras que en el ratón estos genes se encuentran repartidos en los cromosomas 6, 15, 10 y 4. Estos mismos genes se encuentran en un mismo cromosoma en los gatos (cromosoma B4) y en las vacas (cromosoma 5), lo que indica que los antepasados de los ratones divergieron del linaje que desembocaría en el hombre antes que los linajes de los artiodáctilos (grupo al que pertenece la vaca) y el de los carnívoros (grupo al que pertenece el gato). El cromosoma 7 humano posee homologías en siete cromosomas diferentes de Mus musculus. El cromosoma 11 del ratón tiene homologías en, al menos, seis cromosomas humanos.[2]
El parecido genético entre las dos especies permite comparar los genes casi directamente, y permite a los científicos encontrar los mismos genes en humanos para decodificar las rutas y mecanismos de las enfermedades humanas, porque los ratones también pueden desarrollarlas. Por ejemplo, la mutación murina relacionada con la obesidad (“Magohany”) es homóloga al gen attractrin, el cual guarda información para hacer una glicoproteína y que se relaciona con la obesidad en los seres humanos.
También es posible inducirles a los ratones un gran número de enfermedades humanas manipulando sus genes por medio de técnicas de ingeniería genética. Solo de esta manera se pueden hacer investigaciones más fiables, puesto que la investigación con humanos estaría por fuera de las normas bioéticas.
Ratón transgénico
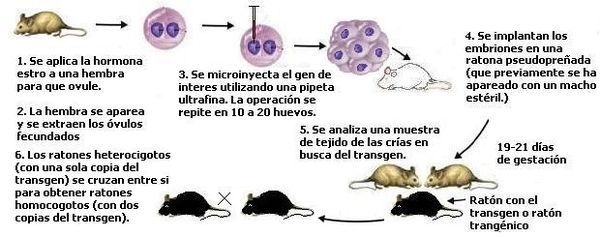
Un ratón transgénico es un ratón que porta un fragmento de ADN ajeno a su genoma. Para obtenerlos es necesario construir un plásmido de ADN (un plásmido es un elemento genético extracromosomal cuya cadena de ADN es circular) y luego se introduce el nuevo gen en la célula blanco para que se inserte al azar en el genoma celular con técnicas de ADN recombinante y de micromanipulación o transfección. El gen añadido recibe el nombre de transgen, y el animal que lo porta el de animal transgénico. Los ratones transgénicos se utilizan para conocer los mecanismos de la expresión génica de un gen o de un fragmento de este.
La obtención de un ratón transgénico se lleva a cabo de la siguiente manera:
- Se obtienen óvulos fecundados, en los que aún no se han fusionado los pronúcleos masculino y femenino, de una ratona a la que previamente se le aplicó una inyección de estro y luego fue apareada.
- Los óvulos fertilizados se remueven del oviducto utilizando una solución salina.
- Por medio de una pipeta de vidrio ultrafina se inyecta al pronúcleo masculino cerca de 2 a 5 picolitros de ADN, en el que hay cientos de copias del transgen.
- El paso anterior se realiza en cerca de 10 a 20 huevos.
- Los huevos microinyectados se implantan en una madre adoptiva (denominada pseudopreñada, pues fue apareada previamente con un macho estéril).
- 19 – 21 días después nacen las crías, de las cuales aproximadamente entre el 10 al 40% tendrán el transgen integrado en su genoma.
- Se toma una muestra de tejido de su cola para averiguar que individuos portan el transgen.
- Se aíslan los ratones transgénicos obtenidos de un huevo microinyectado, denominados transgénicos fundadores.
- Se cruzan ratones transgénicos fundadores para obtener una línea de ratones transgénicos.
El número de copias del transgen puede variar entre diferentes ratones transgénicos fundadores, de igual manera el transgen puede integrarse en diferentes partes dentro del genoma murino. Algunos ratones transgénicos pueden expresar un nuevo fenotipo debido a la inactivación de otro gen debido al lugar de inserción del transgen, lo cual es una desventaja de la técnica. En general los modelos generados permiten estudiar la ganancia de una función.
Un gen tiene dos regiones principales, la región reguladora (promotor) y la región codificadora de la proteína. En la construcción de ratones transgénicos, se pueden usar promotores generales que permiten una expresión continua y generalizada del transgen, o bien, un promotor tejido-específico que producirá un patrón de expresión más restringido.
Ratón knock-out
Un “”ratón knock-out”” (KO) es un organismo genéticamente modificado (OGM) el cual carece de la expresión de un gen en particular. Los ratones KO son un modelo para estudiar la acción de un gen particular en la bioquímica y fisiología de un organismo. Los ratones knock-out son muy útiles en el estudio del cáncer y otras enfermedades complejas.
 Ratón KO.
Ratón KO.
La obtención de un ratón knock-out (o ratón KO) se lleva a cabo de la siguiente manera:
- Se extrae el gen de interés.
- Se propaga el gen en una bacteria.
- Se diseñan modificaciones genéticas para inactivar la función normal del gen.
- Durante la activación se añade un gen que genera resistencia a un antibiótico. Con frecuencia se utiliza el gen Neo, el cual da resistencia a la neomicina. Este gen marcador generará una “selección positiva” (solo las células que lo porten sobrevivirán).
- Se añade también otro gen de selección negativa (las células que lo porten morirán) a los extremos del gen a modificar. Usualmente el gen de selección negativa es el gen timidita quinasa del herpes virus (tk). Este gen debe ser eliminado por la maquinaria celular durante el proceso de recombinación homóloga.
- Se prepara in vitro un vector de ADN. Usualmente el vector es un retrovirus.
- Se pone el vector en contacto con células ES en suspensión. Las células ES provienen de ratonas preñadas a las que se les extrajeron los embriones en el estado de blastocisto, en el tercer día de de desarrollo.
- Se aplica un choque eléctrico (electroporación) que crea poro en la membrana de las células ES permitiendo que entre el vector.
- El gen normal es reemplazado con el gen modificado, a través de un proceso llamado recombinación homóloga.
- Se aplica el antibiótico de selección (usualmente neomicina) al cultivo de células embrionarias.
- Mueren aquellas células que por azar hayan incluido el gen de selección negativa (usualmente el pk) en los extremos del gen. Las células que quedan en el cultivo se denominan recombinantes.
- Se microinyectan entre 10 y 12 células troncales embrionarias (ES por sus siglas en inglés) recombinantes en embriones de ratón.
- Se implantan los embriones en una ratona pseudopreñada.
- Nacen los ratones provenientes de estos embriones. Como los embriones modificados estaban formados por dos tipos de células se dice que estos organismos son quimeras.
- Se realizan cruces para generar una cepa de ratón con un determinado gen modificado. Se tiene en cuenta que solo un 50% de las crías de las quimeras serán recombinantes.
Entre las desventajas que tiene la investigación con ratones knock-out se puede citar: la posible mortalidad de los embriones o los recién nacidos, en algunos casos, lo que impide el estudio de la función de ese gen particular en los animales adultos; La modificación está presente en todas las células, lo cual no se da en el desarrollo de algunos tipos de cáncer; La modificación está presente desde la fecundación, de forma que en algunos casos, la plasticidad durante el desarrollo embrionario puede conducir a una interpretación confusa de los resultados por fenómenos de compensación. A pesar de las anteriores limitaciones el conocimiento de la genética médica ha crecido enormemente gracias a los ratones KO.[3]
Cepas de ratones knock-out
En el 2001 se tenían no menos de 286 cepas de ratones knock-out disponibles. Cada mes se añaden nueve cepas nuevas a la lista. El Jackson Laboratory Induced Mutant Resource (IMR) es la institución que lleva a cabo la importación, criopreservación de embriones, y desarrollo genético (colocando la mutación en una cepa consanguínea) de las cepas aceptadas, para proveer a la comunidad científica de ratones knock-outs y transgénicos para las diferentes áreas de investigación.
El nombre de la cepa se da según el gen involucrado en la mutación. Por ejemplo, la cepa BDNF recibe su nombre de la sigla en inglés de Brain-derived neurotrophic factor (Factor neurotrófico derivado del cerebro). El fenotipo de la cepa con esta mutación se caracteriza por severas deficiencias en coordinación y balance; excesiva degeneración en algunos ganglios sensoriales. El ganglio simpático, el cerebro medio dopaminérgico y las neuronas motoras no se encuentran afectados.
Ratón knock-in
Un ratón knock-in es un organismo genéticamente modificado (OGM) al cual se le ha reemplazado un gen normal por uno alterado con una mutación específica. Su elaboración es muy similar a la de un ratón knock-out, sin embargo, en lugar de inhabilitar el gen este se reemplaza por otro. En algunos casos los que se hace es añadir la sección promotora para hacer que el gen modificado se exprese continuamente.
Historia del ratón de laboratorio
- Hace entre 75 y 125 millones de años vivió el Eomaia scansoria, primer miembro que se conoce del linaje “Eutheria”, antecesor de los mamíferos placentarios (grupo al que pertenece tanto el hombre como el ratón).
- 60 millones de años antes del presente. Vivió el último antepasado común del hombre y el ratón.
- 57 millones de años antes del presente. Se conocen los primeros restos fósiles del orden de los roedores (En el Paleoceno superior).
- 7 millones se años antes del presente. Aparecen los primeros miembros de la familia Muridae desde Europa (En el Plioceno).[4]
- 10.000 años antes del presente. Aparece en el registro fósil los restos de la especie ”Mus musculus”. La convivencia común del hombre y el ratón data de estos tiempos, especialmente por la invención de la agricultura.
- Siglo XVII. En China y Japón se criaban y mantenían ratones con fenotipos particulares, principalmente características ornamentales. Las cepas con estos fenotipos recibieron por nombres: crema roja, amarillo con ojos color rubí, marta cebellina blanca y amarillo cremoso. También se conocían los ratones “bailarines.” Estos ratones generan el movimiento de baile, por un defecto en el [[oído interno que afecta el equilibrio, este defecto es hereditario.
- 1617. Girolamo Fabrizi d'Acquapendente funda la embriología científica con su obra De formato foeti. En ella describió e ilustró el desarrollo embrionario del hombre y del ratón, al igual que de otras 12 especies de vertebrados.[5]
- 1628. William Harvey recurre a los ratones para sus estudios anatómicos. Sus observaciones le ayudan a conocer la circulación sanguínea.
- 1664. Robert Hooke utilizó un ratón para estudiar los efectos del incremento de la presión del aire.
- 1772. Daniel Rutherford descubre que un animal muere si solo tiene nitrógeno molecular para respirar. Rutherford aisló el nitrógeno del aire al meter un ratón en un volumen cerrado de aire hasta que este murió; después encendió una vela y un fósforo en el volumen de aire hasta que dejaron de arder, luego hizo pasar el aire por una sustancia capaz de absorber el dióxido de carbono. El aire restante no era capaz de mantener la combustión de una vela, y un ratón puesto en él murió. Rutherford llamó este gas aire desflogisticado, que hoy conocemos como nitrógeno.[6]
- 1774. Joseph Priestley experimentó la acción de varios gases en los ratones. El logro más grande de Priestley fue el de aislar el oxígeno molecular al concentrar los rayos solares sobre óxido de mercurio. El químico inglés notó que un ratón puesto en este gas no moría, y se mostraba activo.
- Siglo XIX. En Europa se crían varias cepas de ratón teniendo como característica principal de clasificación el color del pelaje. Los mercaderes británicos llevan estas variedades desde el Lejano Oriente.
- 1876. Robert Koch pone a prueba la teoría microbiana de la enfermedad.”” La teoría microbiana de la enfermedad había sido postulada Louis Pasteur años anteriores, pero la confirmación experimental llegó con los trabajos del médico alemán. Koch capturó ratones de un granero y luego los inoculó con la bacteria sospechosa de producir el carbunco (Bacillus anthracis). Después de varias inoculaciones, observaciones y cultivos de estos microorganismos logró demostrar por primera vez la causalidad de una enfermedad por un agente microbiano. Koch desarrolló los postulados que permiten relacionar un microorganismo como causante de una enfermedad particular.
- 1890. Emil von Behring y Shibasaburo Kitasato obtienen suero con anticuerpos antitetánicos.”” Estos científicos demostraron que la inyección de una dosis de toxina tetánica en ratones los hacía resistentes a dosis mucho mayores que las letales, y que además, el suero de estos animales, en ausencia de células, era capaz de neutralizar la toxina tetánica, ya que la mezcla de ese suero y la toxina se podían inyectar en ratones susceptibles sin que sufrieran daño. Behring y Kitasato bautizaron a esta propiedad del suero como antitóxica (primer indicio de la existencia de los anticuerpos).
- 1900. Abbie Lathrop de Massachussets empieza a criar ratones para venderlos a los investigadores de Bostón.”” William E. Castle compró varios de los ratones de Lathrop para estudiar en su laboratorio en Harvard y verificar las leyes de Mendel en cuanto al color del pelaje. Abbie notó que algunos ratones emparentados desarrollaban tumores particulares en las mismas partes, lo cual llamó la atención de científicos de Harvard.
- 1902. El biólogo francés Lucien Cuénot confirma las leyes de Mendel en animales utilizando el ratón. Cuénot había llevado a cabo desde 1898 experimentos de cruces de ratones blancos y grises. El análisis de los experimentos demostró una dominancia del carácter gris sobre el blanco en una proporción de 3:1.[7]
- 1909. Clarence Cook Little, bajo la supervisión de W. E. Castle obtiene un par de ratones portadores de los alelos recesivos: dilución (d), pardo (p) y no agutí (a), y procreó los descendientes hermano con hermana, seleccionando los más vigorosos.
- 1909. Clarence Cook Little, del laboratorio de Castle, desarrolló la primera cepa de ratones endogámicos, denominada DBA”” (así llamada por las iniciales de tres genes mutantes que portaba). Little creía que el cáncer podía deberse a factores hereditarios por lo que se propuso obtener una cepa pura para estudiar su genética. El esfuerzo de Clarence Little desembocaría en la obtención de los actuales ratones de laboratorio.
- 1921. Clarence Cook Little obtiene la cepa C57BL.”” Little logró obtener la actual cepa de ratones de laboratorio de una ratona procedente de la granja de Abbie Lathrop tras realizar cruces endogámicos por veinte generaciones. La C57BL llegó a ser el modelo animal más utilizado en biomedicina, y el que más respuestas ha dado a la oncología. La cepa fue elegida, además de su pureza genética y la rapidez de su reproducción, por no ser agresivos y por ser prometedora en estudios sobre la adicción porque gustan del alcohol y otras drogas.

- 1929. Clarence Cook Little recibe financiación para montar el Laboratorio Jackson.”” Edsel Ford (hijo de Henry Ford) y Roscoe Jackson fueron los donantes. El laboratorio se instaló en Bar Harbor, Maine, EE. UU. La institución llegaría a ser un centro de referencia para la genética del ratón.
- 1940. Howard Florey, Ernst Chain y Norman George Heatley comprueban la propiedad curativa de la penicilina.”” La penicilina, sustancia descubierta por Alexander Flemming en 1928, fue puesta a prueba como medicamento antibiótico por Heatley y sus colegas en medio de la presión de la Segunda Guerra Mundial. Para esto, tomaron ocho ratones, los cuales dividieron en dos grupos: un grupo experimental y un grupo control. Ambos grupos recibieron una inyección intraperitoneal de la bacteria estreptococo. El grupo experimental recibió una dosis subcutánea de penicilina y el grupo control no. En 17 horas los ratones no tratados estaban muertos, mientras que a los que se les administró la penicilina sobrevivieron, dos de ellos estaban curados completamente. El experimento mostró que la penicilina, el primer antibiótico usado en la medicina científica, era eficaz para combatir infecciones bacterianas. Este trabajo marcaría el inicio de los aportes del ratón de laboratorio en la prueba de cientos de medicamentos.
- 1961. Jacques Miller ayuda a establecer que en la respuesta inmune interviene tanto los linfocitos como los anticuerpos. Antes de la segunda mitad del siglo XX los biólogos se encontraban divididos en dos bandos en cuestiones de inmunología: quines defendían la teoría celular o de la fagocitosis y los de la teoría humoral o de los anticuerpos. Miller extirpo el timo en unos ratones de laboratorio y demostró que en ellos se reduce o se pierde el desarrollo de la inmunidad celular. Los experimentos de Miller establecieron que ambos bandos tenían razón, que sus teorías son complementarias, y que el timo es un órgano importante del sistema inmune.
- 1972. El Laboratorio Jackson elabora la primera base de datos genética de mamíferos, precursora de la base de datos genómica del ratón.””
Durante el siglo XX se documentaron las mutaciones espontáneas que permitieron identificar los genes responsables de la obesidad, el cáncer y la aterosclerosis.
- 1982. Richard Palmiter y Martin Evans crean el primer ratón transgénico.”” Los científicos implantaron un gen de rata a un ratón. El gen implantado tiene la información para la hormona del crecimiento. Para hacerlo, los investigadores multiplicaron el gen en el laboratorio, luego lo acoplaron al genoma del ratón y se procedió a inyectar el combinado genético en 170 [[óvulos fecundados de ratón, que finalmente se implantaron en seis ratonas. Estas hembras dieron a luz a 21 crías, seis de ellas fueron ratones que crecían con mayor rapidez alcanzando un tamaño un 50% mayor del de sus hermanos.
- 1986. Allan Bradley y Elizabeth Robertson generan un ratón transgénico utilizando células troncales embrionarias (ES).”” Bradley y Robertson demostraron que era posible extraer células particulares de un embrión de ratón —conocidas como células troncales embrionarias, o ES (por sus siglas en inglés), alterarlas genéticamente y reimplantarlas. Estas células modificadas, darían origen a un ratón manipulado genéticamente. Robertson y Bradley utilizaron un retrovirus como vector para incorporar en las ES los genes que deseaban.
- 1987. Mario Capecchi crea el primer ratón knock-out””. El investigador italiano, colaborador del HHMI (Instituto Médico Howard Hughes), desarrolló una técnica capaz de insertar o eliminar un gen determinado en las células ES del ratón. Los ratones de laboratorio a los que se ha eliminado selectivamente la expresión de un gen recibieron el nombre de ratones “knock-out” (KO). Por este trabajo Capecci recibió el Premio Nobel en Fisiología o Medicina en 2007 junto con Oliver Smithies y Martin Evans.
- 1998. Ruyzo Yanahimachi y otros investigadores consiguen clonar el primer ratón: “Cumulina”.”” Estos investigadores de la Universidad de Hawaii lograron clonar por segunda vez un mamífero, después de la famosa oveja Dolly. La ratona recibió este nombre porque para su clonación se utilizaron células inactivas de división celular del ovario que rodean y mantienen al óvulo en formación denominadas cúmulos. Para obtener la Cumulina se requirieron no menos de 84 intentos. La eficacia de la técnica estuvo entre el 2% y el 2.8%.
- 1999. El Laboratorio Jackson alcanza la cifra de más de mil mutaciones descubiertas en el genoma murino.”” Este centro también informó que a esta fecha se había alcanzado a secuenciar 128 mutaciones y que el 45% de ellas tienen mutaciones homólogas en los humanos relacionadas con enfermedades.
- 1999. Se forma el Consorcio de Secuenciación del Genoma del Ratón formado por con tres grandes institutos de Estados Unidos y Gran Bretaña.
- 2001. La firma privada Celera Genomics empieza a vender su secuencia genética del ratón obtenida por la técnica shotgun, que se extrajo de cuatro cepas de ratón.
- 2002—Mayo. La revista Science publica la secuencia del cromosoma 16 del ratón, que tiene gran similitud con el cromosoma 21 humano.
- 2002—Agosto. Un consorcio internacional facilita el marco para la determinación total del genoma del ratón, gracias a la creación de un mapa físico del genoma.
- 2002—Diciembre. ””El Consorcio de la Secuenciación del Genoma del Ratón publica la secuencia del genoma y el análisis genético de la cepa C57BL/6J””. La doctora Shirley Tilghman calificó al genoma del ratón como la “piedra de Rosetta” que ayudará a comprender el genoma humano.
La historia subsiguiente incluye la creación de una gran cantidad de variedades de ratones knock-out para ayudar a entender el papel que desempeña cada uno de los genes en el organismo y la forma como se relaciona con otros genes.
Referencias
- ↑ Meraz Ríos Marco Antonio y Sánchez Torres Carmen, Animales Modificados Genéticamente. La Herramienta del Futuro.
- ↑ Evolución comparada de genomas animales y su relación con el genoma humano (capítulo 6) en El Genoma Humano. Panamericana editorial.., Ruiz García, Manuel y Álvarez Diana. 1º Edición. Bogotá 2002.
- ↑ El ratón como modelo animal en oncología: Pasado, presente y futuro. En Boletín Oncológico del área sanitaria de Teruel. Marzo de 2007.| Jímenez Schuhmacher, Alberto
- ↑ Roedores. En “Pequeños herbívoros” Ediciones Folio. Estella. 1991. | Dubock, Adrian C.
- ↑ De la magia primitiva a la medicina moderna. Fondo de Cultura económica. | Pérez Tamayo, Ruy
- ↑ Breve Historia de la Química. Educational Serveces Incorporated. 1975.. | Asimov, Isaac.
- ↑ La relación del hombre con el ratón casero. En “Pequeños herbívoros” Ediciones Folio. Estella. 1991. | Berry, R. J.
Categorías: Medicina | Historia de la medicina | Genética | Biotecnología | Organismos modelo
Wikimedia foundation. 2010.